Скачать статью в PDF формате
English version
Фауна, морфология и систематика паразитов
УДК 619:616.995.122:636.611.018
ПАТОМОРФОЛОГИЯ ОРГАНОВ И ТКАНЕЙ Fasciola hepatica и
Paramphistomum cervi ПОСЛЕ ВОЗДЕЙСТВИЯ АНТИТРЕМА
кандидат биологических наук Л.В. НАЧЕВА
доктор биологических наук
Кемеровская государственная медицинская академия, 650029, г. Кемерово, ул. Ворошилова, д. 22а,
e-mail: ok.bibik@yandex.ru
И.А. АРХИПОВ
доктор ветеринарных наук
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, д. 28,
e-mail: vigis@ncport.ru
Ключевые слова: антитрем, Fasciola hepatica, Param- phistomum cervi, гистохимия, патоморфология.
Наиболее действенной мерой борьбы с гельминтозами является химио- терапия с использованием высокоэффективных антигельминтиков, к которым относится антитрем [1, 2, 13].
Дегельминтизация требует более эффективных трематодоцидных средств, изыскание которых, помимо традиционных методов скрининга, це- лесообразно проводить путем гистологических, гистохимических и элек- тронномикроскопических методов с разносторонним изучением механизма воздействия антигельминтиков на паразита, а также изучать в динамике структурные и функциональные изменения в тканях гельминта и в некоторых органах хозяина [3, 6, 17].
Исходя из этого, мы поставили цель выявить патоморфологические и ги- стохимические особенности органов и тканей Fasciola hepatica и Paramphis- tomum cervi после воздействия антитрема и определить их как соответствую- щие критерии эффективности антигельминтика.
Материал для исследований получали при вскрытии спонтанно инвази- рованных фасциолами коров и парамфистомами овец через 7 сут после дачи антитрема в дозе 200 мг/кг по ДВ однократно перорально. В качестве кон- троля исследовали фасциол и парамфистом до воздействия антитрема. Мате- риал фиксировали в 70%-ном спирте и обрабатывали по общепринятым ги- стологическим методикам. Парафиновые срезы толщиной 5-6 мкм окрашива- ли гематоксилином и эозином, по Маллори. Из гистохимических красителей использовали толуидиновый синий (ТС), альциановый синий (АС), бромфе- ноловый синий по Бонхегу (БФС) и Шик-реакцией по Мак-Манусу с соответ- ствующими ферментативными и химическими контролями [19].
Результаты и обсуждение
Воздействие разных антигельминтиков проявляется изменениями реак- тивности тканей F. hepatica и P. cervi при реакциях АС, ТС, БФС и Шик- реакции, что указывает на нарушение физиологического состояния гельмин- тов [4, 5, 7].
Данные исследования показали, что в результате интоксикации после воздействия антитрема в организме трематод происходит нарушение водно- электролитного и белкового обмена, что приводит к изменению коллоидно- осмотического давления и развитию гидропической дистрофии тканей гель- минтов. Накопление воды вызывает набухание, расплавление и вакуолиза- цию тканевых и клеточных структур. После воздействия антитрема на F. he- patica и P. cervi в тканях и органах трематод отмечается выраженный отек и колликвационный некроз.
Выявляли атипичную вакуолизацию наружной части тегумента F. hepat- ica. Увеличение проницаемости тегумента для воды приводит к гипергидра- тации покровной ткани и увеличению межклеточных пространств. Эти наблюдения подтверждают результаты наших исследований.
Чувствительными к антитрему оказались как покровные ткани, так и пищеварительная система F. hepatica и P. сervi (табл. 1, 2). Избирательное воздействие антигельминтиков на тегумент и эпителий кишечника обсужда- лось нами ранее. Антитрем преимущественно проникает в организм трематод через тегумент. Выраженный лизис структурных элементов кишечного эпи- телия трематод приводит к нарушению процессов всасывания и подтвержда- ет высокую степень проникновения препарата через пищеварительную си- стему трематод.
1. Морфофункциональные изменения и патогенез в органах и тканях
F. hepatica и P. cervi после воздействия антитремом
|
Патологический процесс |
Органы |
|||||
|
тегумент |
кишечник |
паренхима |
||||
|
F.hepatica |
P.cervi |
F.hepatica |
P.cervi |
F.hepatica |
P.cervi |
|
|
Дистрофия: |
+++ |
++ |
++ |
++ |
+++ |
++ |
|
гидропическая |
||||||
|
углеводная |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
белковая |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Аутолиз |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Базофилия ткани |
+++ |
++ |
+++ |
++ |
+++ |
++ |
|
Деструкция |
+++ |
++ |
+++ |
++ |
+++ |
++ |
|
Дезорганизация |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Декомпозиция |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Некробиоз |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
|
Некроз |
++± |
+ |
+++ |
++ |
+++ |
++ |
П р име ч а н и е к т а б л и ц а м 1 - 3 . + (плюс) – положительная реакция; – (минус)
– отрицательная реакция; + – патологическая картина с незначительными морфо- функциональными изменениями после воздействия антигельминтика; ++ – выражен- ные морфофункциональные изменения; +++ – необратимые процессы патогенеза; ± – процессы с разной степенью проявления.
На изменение реактивности тканей трематод, их функционального со- стояния указывает увеличение базофильности тканевых структур. Это свиде- тельствует о смещении в сторону кислотности ткани внутренней среды в ор- ганизме трематод. Снижение рН среды и активация гидролитических фер- ментов повышает гидролиз высокомолекулярных соединений в тканях, спо- собствуя разрушению белково-полисахаридных комплексов. Происходит де- струкция клеточных и тканевых структур. Наиболее вероятно, что при взаи- модействии антигельминтика с биополимерами тканей гельминта изменяется
число ионогенных групп биосубстрата, что приводит к смещению рН внут- ренней среды и набуханию структур организма трематод.
Адсорбируясь изначально на поверхности тела гельминта, антигельмин- тик блокирует мукополисахаридный слой гликокаликса, покрывающий тегу- мент трематод. Этот компонент влияет на свойства клеточной поверхности - всасывание, иммунологическое поведение, адгезивные силы, выполняет ба- рьерную функцию в сложившейся системе «паразит-хозяин» [10, 18, 24-26]. Гликокаликс - сильно ионизированный мукополисахарид, а образуемая им сеть может выполнять функции молекулярного сита, ионообменника, избира- тельно накапливающего некоторые типы молекул, предупреждая проникно- вение на поверхность липопротеиновой мембраны крупных частиц и бакте- рий [20, 21]. Аналогичные механизмы были выявлены при изучении функци- ональной морфологии разных трематод [16]. Наружная сторона гликокаликса контактирует с внутренней средой хозяина, а внутренняя – с цитоплазмати- ческим матриксом – наружной частью тегумента. Поэтому, даже небольшие концентрации токсических веществ, чем и является действующий антигель- минтик и его метаболиты, могут или блокировать, или разрушать структуру рецепторов тегумента паразита, что пагубно сказывается на регуляции его клеточного метаболизма, а затем организма гельминта в целом (по принципу
«цепной реакции»). Нарушение защитного барьера – зоны гликокаликса рез- ко усиливает явления проницаемости. Далее, абсорбируясь во внутренние отделы организма, препарат снижает количество углеводного компонента в наружном слое тегумента трематод, и паразит теряет способность защищать организм от внешнего воздействия.
Нарушение антитремом тинкториальных свойств в пограничных зонах трематод – тегументе и кишечном эпителии подтверждается ослаблением окрашивания тканевых структур АС. Незначительное количество гексозами- ногликанов (ГАГ) свидетельствует о разрушении защитного барьера в погра- ничных органах.
Увеличение содержания Шик-положительных веществ в тканях трематод подтверждает токсичность препарата на состояние ферментативных систем. Последнее доказывается снижением реакции с БФС и извращенным окраши- ванием тканевых структур трематод. Накопление веществ углеводного харак- тера указывает на нарушение обмена веществ за счет их нерасходования в процессе жизнедеятельности. Выявляется прокрашивание скорлупы яиц, осо- бенно, у F. hepatica, что указывает на ее повышенную проницаемость.
Возрастание степени интенсивности положительной Шик-реакции сви- детельствует об увеличении полисахаридов. Возможно, это происходит за счет групп каких-либо внешних источников (например, полисахаридов це- ментирующего вещества, скрепляющего отдельные структуры в ткани) или из-за 1,2-гликолевых групп, присутствующих в коллагеновых волокнах, что и было характерно для базальных мембран. Реакционно способные группы в нормальных условиях не могут вступать в реакцию вследствие их химического замещения, либо их блокировки факторами физико-химической природы.
Вопрос о перестройке белково-углеводных комплексов после воздей- ствия антигельминтных препаратов, с образованием Шик-положительных углеводов и свободных белков, которые дают усиление окрасок на полисаха- риды и белок, уже обсуждался ранее [14].
Воздействие антитрема выражалось уменьшением или исчезновением метахромазии хромотропных структур, что указывает на снижение в тканях гельминтов ГАГ или нарушении их структурной организации. Исчезновение хромотропов из органов и тканей трематод связано с прижизненным возник- новением комплексов между этими структурами трематод и нехромотропны- ми веществами – антигельминтиками или их метаболитами. Препараты взаи- модействуют с активными кислотными группами тканевого субстрата. Обра- зование подобных комплексов приводит к уменьшению активных центров – реакционно способных групп, количество которых в субстрате снижается, расстояние между ними увеличивается и они встречаются реже, что и вызы- вает ослабление окраски.
Бледное окрашивание ТС паренхимы трематод с ослаблением эффекта метахромазии свидетельствует о структурной дезорганизации основного це- ментирующего вещества соединительной ткани. Происходит нарушение изо- осмии ткани внутренней среды и гомеокинеза гельминта, тело трематод теря- ет упругость, меняется его форма.
Выявление сульфатированных мукополисахаридов в тегументе трематод связывают с их участием в регуляции ионного равновесия процессов диффу- зии на уровне тканей гельминтов, что свидетельствует об избирательной проницаемости покровной ткани трематод и ее взаимозависимости не только с обменными процессами самого паразита, но и с метаболизмом хозяина [16]. Уменьшение содержания муциноподобных веществ нарушает избирательную проницаемость тканей, ослабляя роль тегумента и кишечного эпителия в за- щитных реакциях организма; гельминты становятся уязвимыми со стороны эндостации хозяина.
После антитрема в тегументе и кишечнике выявлено большое число ядер (табл. 2), сохраняющих контур границ, но с прозрачным содержимым, что указывает на разрушение генетического материала трематод в жизненно важ- ных структурах. Наблюдаемая пролиферация ядер дистальной части тегумен- та и базальной части эпителия кишечника после воздействия антитрема под- тверждает патологию клеточного ядра, происходящие изменения его функ- ционального состояния. На увеличение содержания нуклеиновых кислот (ДНК) указывает возрастание базофильности кариоплазмы. Реакция проли- ферации характеризует воспалительный процесс, возникающий в результате токсического воздействия [12], в данном случае, антигельминтика.
2. Морфофункциональные изменения ядер тегумента и кишечного эпителия
F. hepatica и P. cervi после воздействия антитремом
|
Патологический процесс |
Ядро |
|
|
F. hepatica |
P. cervi |
|
|
Базофилия |
– |
+++ |
|
Пролиферация |
Только в эпителии |
+ |
|
Пикноз |
+++ |
– |
|
Лизис |
+++ |
+++ |
Разрушение тегумента и кишечного эпителия трематод как мультифунк- циональных органов [15], обеспечивающих динамическую стабилизацию гельминта, способствует усилению токсикогенного влияния и проникновения антигельминтика в организм паразита, оказывая воздействие на паренхиму – ткань внутренней среды, а далее органы половой системы.
Выявление ГАГ в эпителии матки, желточниках и яйцах у F. hepatica и
P. cervi после воздействия антитрема в большем количестве, чем при норме свидетельствует о повышении секреторной активности органов и их защит- ной функции. Такая картина характерна и для трематод других видов [9, 16].
Основной принцип химиопрофилактики – губительное воздействие ма- лых доз лекарственных препаратов на развивающихся и развившихся яиц гельминтов, и угнетение их репродуктивных свойств [11, 22].
Антитрем вызывает значительные микроморфологические изменения цитоархитектоники половых желез (табл. 3), нарушения процессов спермато- генеза, овогенеза и вителлогенеза, а также прекращение развития яиц в раз- ных отделах матки фасциол и парамфистом, но ответные реакции трематод определяются их видовой специфичностью.
Окрашивание тканей БФС показывает присутствие суммарных белков в определенном месте. После воздействия антитрема у трематод в тканевых
структурах всех органов происходило изменение природы белкового компо- нента, перераспределение его функциональных групп, о чем свидетельство- вало извращенное окрашивание БФС.
3. Морфофункциональные изменения и патогенез в органах репродуктивной системы F. hepatica и P. cervi после воздействия антитремом
|
Патологический процесс |
Органы |
|||
|
яичник |
семенники |
|||
|
F.hepatica |
P.cervi |
F.hepatica |
P.cervi |
|
|
Дистрофия: |
+++ |
++ |
+++ |
++ |
|
гидропическая |
||||
|
углеводная |
+++ |
+++ |
+++ |
+ |
|
белковая |
+++ |
+++ |
+ |
+ |
|
Аутолиз |
+++ |
++ |
+++ |
++ |
|
Базофилия |
+ |
+ |
+ |
++ |
|
Деструкция |
+++ |
++ |
+++ |
++ |
|
Дезорганизация |
+++ |
+++ |
+++ |
+++ |
|
Декомпозиция |
+++ |
+++ |
+++ |
+++ |
|
Пикноз ядер |
++ |
– |
++ |
+ |
|
Лизис ядер |
+++ |
+ |
+++ |
+ |
|
Некробиоз |
+++ |
+++ |
+++ |
+++ |
|
Некроз |
+++ |
++ |
+++ |
++ |
Воздействие антитрема вызывало перераспределение в сторону кислых белков у P. cervi со стороны кишечного эпителия. Изменение цветовой гаммы тканевых структур в реакции с БФС после воздействия антитрема у F. hepati- ca и P. cervi указывает на большее количество мукополисахаридов. Воздей- ствие антитрема на F. hepatica приводило к наличию нехарактерного, корич- невого и болотного, окрашивания тканевого субстрата. Препарат, вероятно, вызывает денатурацию белков необратимого характера.
Окрашивание тканей трематод БФС на белки выявляет наличие хлопье- видной массы коагулирующего белкового компонента, выпадающего в виде осадка в большом количестве после воздействия антитрема.
При разрушении белково-углеводных комплексов, происходит освобож- дение анионных центров, которые задерживают антигельминтики – катион- ные молекулы, образуя комплексы. Поэтому, мы считаем, что при взаимо- действии в системах «антигельминтик-полимер ткани», с одной стороны, мо- гут образовываться солевые связи между антигельминтиком и карбоксилани- онами поликислот, которыми и являются ГАГ ткани паразита, а с другой сто- роны, молекулы препарата могут связываться с основной цепью белково- углеводного комплекса благодаря неполярным взаимодействиям.
Установлено, что изменение химической структуры фасциолоцидов вли- яет на избирательную токсичность: антигельминтики с карбоциклическим строением активнее ациклических; разделение фенольных колец у производ- ных дифенилов метиленовой группой и в большей степени серой и еще больше окисленной, уменьшает фасциолоцидную эффективность; с увеличе- нием атомов хлора в соединении возрастает эффективность препарата; ак- тивность соединений, содержащих нитрогруппы, выше, чем содержащих атом брома [23].
Гистохимически установлено, что антитрем вызывает структурные из- менения в тканях тегумента, паренхимы, пищеварительной и половой систем трематод (рис.), которые выражались дистрофиями разного генеза: 1) деком- позицией – деструкция углеводно-белковых комплексов с высвобождением и накоплением составляющих их химических веществ (белков, углеводов); 2) инфильтрацией (дистрофия количественного характера) – накопление белков и углеводов в результате истощения ферментных систем, метаболизирующих эти продукты; 3) извращенным синтезом (дистрофия качественного характе- ра) на уровне белков – нарушение ферментативных процессов (ферментопа- тия). Гистохимическая гиперплазия характеризовалась увеличением количе- ства белков хлопьевидной формы, что проявлялось при БФС окрашивании и указывало на нарушение внутриклеточного транспорта продуктов метабо- лизма. Выявляемый некробиоз тканей трематод подтверждал необратимые дистрофические изменения на уровне нарушения углеводного и белкового обменов. Исчезновение гликогена после воздействия антигельминтика ука- зывает на преобладание в тканях трематод катаболических реакций над ана- болическими, а значит происходит нарушение биохимических путей синтеза жизненно важных веществ.
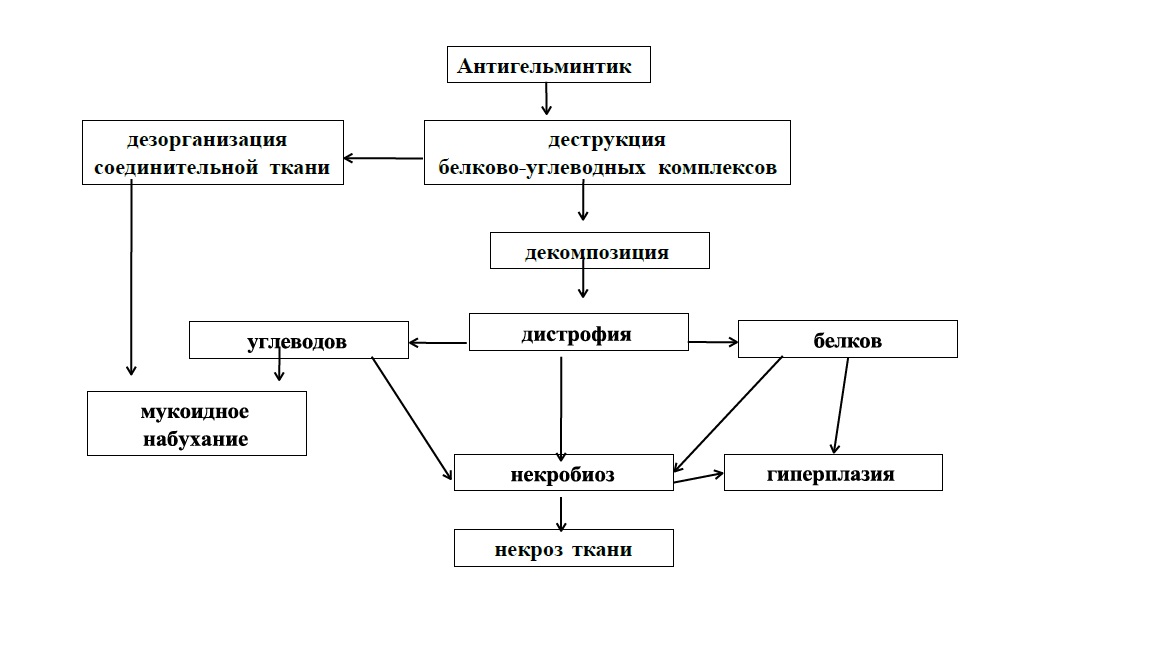
Рис. Схема механизмов морфофункциональных изменений тканей трематод после воздействия антигельминтиков
Воздействие антигельминтиков на органы и ткани F. hepatica и P. cervi выражалось постепенными изменениями: 1) деформацией, вакуолизацией, отечностью, некрозом тегумента и кишечного эпителия; 2) набуханием, угле- водно-белковой инфильтрацией всех соединительнотканных волокон, их ли- зисом; 3) исчезновением гликогена как запасного питательного материала, частичными некротическими явлениями; 4) декомпозицией половых желез, инфильтрацией их клеток и волокон углеводами, извращенным синтезом белков, разрушением цитофоров и распадом клонов, их смешиванием, с участками коагуляционного некроза; 5) разрушением зрелых яиц и морфо- функциональных блоков их формирования, нарастающей дистрофией жел- точников с распадом желточных клеток, их декомпозицией и склеротизацией гранул; 6) извращенным и нарастающим снижением окрашивания тканей при реакциях толуидиновым, бромфеноловым и альциановым синим, Шик- реакцией, что свидетельствовало о белково-углеводной дистрофии.
После воздействия антитрема морфологические изменения однотипных морфофункциональных процессов (декомпозиция, дезорганизация и др.) в организме F. hepatica и P. cervi проявляются специфично. Это связано не только с тем, что трематоды разной видовой принадлежности, но и с тем, что они занимают в организме хозяина разные паразитарные ниши – эндостации. О специфических изменениях в тканях у представителей разных видов гель-
минтов после воздействия одних и тех же антигельминтиков упоминалось в работах других исследователей [8].
Таким образом, исследования показали, что патоморфологический кон- троль тканей трематод и их гистохимическую реактивность можно использо- вать как критерии оценки эффективности воздействия антитрема на F. hepati- ca и P. cervi. Степень воздействия антигельминтика на органы и ткани трема- тод определяется химической структурой препарата и является процессом, сопровождаемым определенной морфологической перестройкой, в основе которой лежат тонкие изменения внутриклеточного метаболизма.
Нарушение белкового и углеводного обмена с перераспределением и накоплением компонентов в тканях трематод кислого характера, приводящее в исходе к необратимым процессам некробиоза и некроза тканевых и орган- ных структур гельминта, подтверждает сильную степень фасциоло- парамфи- стомоцидного воздействия антитрема. Но необратимые некротические изме- нения тканей после воздействия антитрема более значительные в организме фасциол, чем парамфистом.
Литература
1. Архипов И.А. Химиотерапия гельминтозов животных: успехи, пробле- мы, перспективы // Основные достижения и перспективы развития паразито- логии // Матер. докл. Междунар. конф. – М., 2004. – С. 30–31.
2. Архипов И.А. Антигельминтики: фармакология и применение. – М., 2009. – 405 с.
3. Бибик О.И. Микроморфология органов и тканей Fasciola hepatica, взя- тых после лечения антитремом // Сб. науч. тр. «Медико-биологические про- блемы». – Кемерово, 2005. – Вып. 14. – С. 77–79.
4. Бибик О.И. Патоморфологический контроль токсикогенного действия тегалида на органы и ткани Paramphistomum cervi // Тр. Всерос. ин-та гель- минтол. – 2006. – Т. 44. – С. 46–52.
5. Бибик О.И. Гистохимические исследования нарушения углеводного обмена в тканях и органах фасциол после воздействия тегалида // Тр. Всерос. ин-та гельминтол. – 2007. – Т. 45. – С. 40–45.
6. Бибик О.И. Морфофункциональная характеристика органов и тканей паразита и хозяина при трематодозах после химиотерапии антигельминтика- ми // Рос. паразитол. журнал. – 2008. – № 1. – С. 99–106.
7. Бибик О.И., Начева Л.В. Гексозаминогликаны в органах и тканях по- ловозрелых Fasciola hepatica после воздействия триклабендазола // Рос. пара- зитол. журнал. – 2008. – № 3. – С. 72–76.
8. Богоявленский Ю.К., Казанцева Г.Н. Гематологические и гистохими- ческие исследования тканей гельминтов и органов их хозяев в химиотерапии гельминтозов // Тез. докл. науч. конф. «Эколого-биологические и фаунисти- ческие аспекты гельминтозов». – М., 1991. – С. 17.
9. Гребенщиков В.М. Микроморфологические и гистохимические иссле- дования половой системы и гаметогенеза некоторых трематод в норме и при действии антигельминтиков: Автореф. дис... канд. биол. наук. – Алма-Ата, 1984. – 20 с.
10. Давыдова В.Г. Ультраструктурные исследования цестод в аспекте взаимоотношений в системе «паразит-хозяин» // Тез. докл. науч. конф.
«Гельминтология сегодня: проблемы и перспективы». – М., 1989. – С. 104.
11. Демидов Н.В., Поникаров А.В. Опыт применения лечебных антигель- минтных композиций пролонгированного действия для профилактики фас- циолёза ягнят // Тез. докл. науч. конф. «Эколого-биологические и фаунисти- ческие аспекты гельминтозов». – М., 1991. – С. 41–42.
12. Казанин В.И. Систематика клеточных реакций в патологии. – М.: Ме- дицина, 1983. – 69 с.
13. Кошеваров Н.И. Эколого-эпизоотологические особенности тремато- дозов жвачных в Нечерноземье РФ и влияние антигельминтиков в системе
«паразит-хозяин»: Автореф дис... д-ра вет. наук. – М., 2011. – 49 с.
14. Кошкина Н.Г. Празиквантель при экспериментальном фасциолезе крыс // Матер. докл. VII науч. конф., посвящ. теор. и практ. вопр. общей и экологической паразитол. – Кемерово, 1984. – С. 31–33.
15. Начева Л.В. Сравнительная морфофункциональная организация ки- шечника трематод // Тез. докл. VIII науч. конф., посвящ. теор. и практ. вопр. общей биологии и паразитол. – Кемерово, 1985. – С. 43–48.
16. Начева Л.В. Морфоэкологический анализ и эволюционная динамика тканевых систем трематод, реактивность их органов и тканей при действии антигельминтиков: Автореф. дис… д-ра биол. наук. – М., 1993. – 57 с.
17. Начева Л.В., Бибик О.И., Гребенщиков В.М. Антигельминтики, эф- фективность их действия на органы и ткани Opisthorchis felineus (гистологи- ческие и гистохимические исследования). – Кемерово, 2000. – 92 с.
18. Перминов А.А., Воробьева Е.И. Морфоэкологические особенности ад- гезии между гельминтом и хозяином в зависимости от эндостации паразити- рования // Сб. науч. раб. «Медико-биологические проблемы». – Кемерово, 1995. – С. 26–27.
19. Пирс Э. Гистохимия. – М., 1962. – 962 с.
20. Уголев А.М. Мембранное пищеварение. Полисубстратные процессы, организация и регуляция. – Л.: Наука, 1972. – 356 с.
21. Уголев А.М. Эволюция пищеварения и принципы эволюции функций: элементы современного функционирования. – Л.: Наука, 1985. – 544 с.
22. Федянина Л.В., Астафьев Б.А., Коваленко Ф.П., Найденова А.С. Изу- чение овицидного и ларвицидного эффекта отечественных антигельминтиков
// Матер. докл. науч. конф. «Гельминтозоонозы – меры борьбы и профилак- тика». – М., 1994. – С. 168–170.
23. Ханбегян Р.А. Поиск фасциолоцидов преимагинального действия и некоторые стороны их антигельминтного механизма и фармакодинамики: Автореф. дис. ... д-ра вет. наук. – М., 1977. – 45 с.
24. Ястребов М.В. Соотношение понятий «хозяин» и «среда обитания» и вопрос о сущности паразитизма // Экология. – 1996. – Т. 27, № 1. – С. 61–64.
25. Gabrion C., Gabrion J. Etude ultrastructurale de la larva de Ahomataenia constricta (Cestoda, Cyclophyllidea) // Ztschr. Parasitenc. – 1976. – Bd. 49, № 2. – P. 164–177.
26. Threadgold L.T., Befus A.D. Hymenolepis diminuta: ultrastructural locali- zation of immunoglobulin – binding sites on the tegument // Exp. Parasitol. – 1977.
– V. 43, № 1. – P. 169–179.
© 2016 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin.
This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI) and the Agreement of 12.06.2014 (CABI.org / Human Sciences section).