УДК 619:616.995.122
МИКРОСТРУКТУРА ТОНКОЙ КИШКИ ОВЕЦ ПРИ ПАРАМФИСТОМОЗЕ ПОСЛЕ ВОЗДЕЙСТВИЯ АНТИТРЕМА
кандидат биологических наук Л.В. НАЧЕВА
доктор биологических наук
Кемеровская государственная медицинская академия, 650029, г. Кемерово, ул. Ворошилова, д. 22а,
e-mail: ok.bibik@yandex.ru
И.А. АРХИПОВ
доктор ветеринарных наук
Всероссийский научно-исследовательский институт гельминтологии им. К.И. Скрябина, 117218, г. Москва, ул. Б. Черемушкинская, д. 28,
e-mail: vigis@ncport.ru
Ключевые слова: антитрем, парамфистомоз, тонкая кишка, овцы, пролиферация, дистрофия, гиперплазия, гистохимия, патоморфология.
Парамфистомоз широко распространен во многих странах мира, в том числе в России и наносит значительный экономический ущерб животновод- ству [3–6].
Основной метод борьбы с парамфистомозом – дегельминтизация хими- ческими препаратами, всестороннее изучение которых имеет большое значе- ние для теоретической и практической паразитологии [1, 2].
Исходя из этого, мы поставили цель изучить микроморфофункциональ- ные особенности тонкой кишки овец при парамфистомозе после воздействия антитрема.
Материалы и методы
Материал для исследований получали при вскрытии спонтанно инвази- рованных Paramphistomum cervi овец через 7 сут после дачи антитрема в дозе 200 мг/кг по ДВ однократно перорально, фиксировали в 70%-ном спирте и обрабатывали по общепринятым гистологическим методикам. Парафиновые срезы толщиной 5–6 мкм окрашивали гематоксилином и эозином, по Малл- ори. Гистохимически препараты окрашивали толуидиновым синим (ТС), аль- циановым синим (АС), бромфеноловым синим по Бонхагу (БФС) и Шик- реакцией по Мак-Манусу с соответствующими контролями [7].
Результаты и обсуждение
После воздействия антитрема в кишечнике животных отмечали деструк- цию ворсинок и крипт. Происходило нарушение структуры подслизистой, мышечной, серозной оболочек и кровеносных сосудов. Наблюдали дегенерацию эпителия слизистой оболочки, которая выражалась отечностью, разру- шением формы и разрыхлением компонентов ее слоев (рис. 1 А). Выявляли очаги клеточной пролиферации в эпителии слизистой оболочки; усиливалась вакуолизация цитоплазмы эпителиальных клеток.
Эпителий ворсинок и крипт выглядел высоким, имел интенсивно окра- шенные базофильные ядра и оксифильную цитоплазму с крупными и много- численными секреторными включениями в апикальных частях клеток. Бока- ловидные клетки были увеличены в размерах, их базальная часть представле- на в виде удлиненных мешочков, погруженных в строму ворсинки. После воздействия антитрема усиливалась активность слизеобразующих экзокрино- цитов. В некоторых участках кишечника обнаруживали десквамацию его эпителия. Базальная мембрана эпителия имела извилистые волокна набухше- го коллоидного вида. В связи с этим, граница слизистого и подслизистого слоя выглядела неровной – зигзагообразной. Под мембраной выявляли силь- ную вакуолизацию ткани. Происходило разволокнение соединительной ткани стромы ворсинок. Выражена клеточная инфильтрация слизистой оболочки.
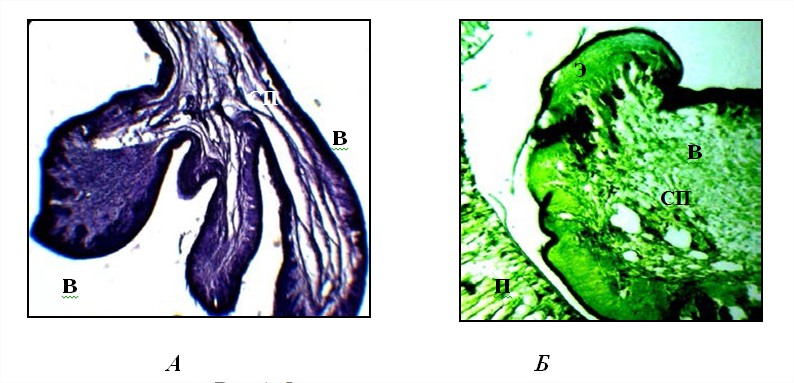
Рис. 1. Фрагменты тонкого кишечника овцы:
В – кишечная ворсинка; Э – эпителий; СП – собственная пластинка слизистой обо- лочки; П – паразит (увел. ок. 10 х об. 8 (А), 20 (Б). Окраска гематоксилином и эози- ном (А), бромфеноловым синим (Б)
Преобладали пролиферативно-гиперпластические явления в виде увели- чения и пролиферации клеток эпителия ворсинок и крипт слизистой оболоч- ки. В эпителии ряда либеркюновых желез имела место многорядность ядер, которые были крупнее и базофильнее, что служит доказательством наличия дисплазии в кишечном эпителии.
В ворсинах наблюдали скопление эозинофилов, оболочка клеток кото- рых была сохранена, ядра некротизированы (пикнотичны), зернистые вклю- чения клеток были лизированы под влиянием антитрема и цитоплазма клеток окрашивалась тотально в оранжевый цвет по Маллори. Этот феномен ранее никто не описывал. Поэтому можно считать, что гибель эозинофилов представ- ляет интерес для дальнейших исследований. В данном случае следует констати- ровать, что влияние антигельминтика блокирует эозинофильный эффект воздей- ствия на окружающие ткани хозяина, то есть вызывает их гибель.
Установлено резкое увеличение популяции клеток крипт, а между крип- тами наличие диффузной инфильтрации лейкоцитами слизистой оболочки кишечника. В строме подслизистой основы отмечали расширение и полно- кровие сосудов, границы их были не четкие, размыты за счет лизиса тканей, выявляли скопление эритроцитов. В клетках соединительной ткани подсли- зистой основы наблюдали некротизацию ядер и их кариорексис. Некоторые клетки находились на стадии некробиоза. Соединительнотканные и мышеч- ные волокна подслизистой основы были разволокнены, местами разорваны. Их деструкцию можно объяснить пролонгированным отеком межтканевого пространства. Это так называемая викарная гипертрофия (один из вариантов дистрофии).
Гистохимический анализ тканей слизистой оболочки кишечника показал, что после введения антитрема в пищеварительной системе овец происходило нарушение углеводного и белкового обменов, о чем свидетельствовало изме- нение ее тканевых структур и нарушение их тинкториальных свойств при окрашивании БФС, ТС и АС. При Шик-реакции интенсивность окраски эпи- телиального слоя слизистой оболочки уменьшалась и резко видоизменялась по сравнению с нормой. Эпителий либеркюновых желез при гистохимиче- ском исследовании обладал большей восприимчивостью к реактиву Шиффа в сравнении с эпителием, покрывающим ворсины. Шик-реакция выявила ин- тенсивное окрашивание апикальной части эпителия крипт, что свидетель- ствует о скоплении мукоидного секрета в связи с морфофункциональными нарушениями в данных участках слизистой оболочки.
Наличие суммарных белков выявить не удалось при окрашивании БФС, о чем свидетельствовало отрицательное окрашивание. В строме ворсинок белковый компонент полностью отсутствовал, в то время как в эпителиаль- ном слое слизистой оболочки белки представлены веществами кислой приро- ды. На изменение химической структуры белков указывало извращенное окрашивание эпителиальной ткани в зеленый цвет БФС (рис. 1 Б). Возможно, после дегельминтизации происходит накопление и прекращение выброса ферментов, реализующих кислотный гидролиз.
При окрашивании АС в апикальных отделах клеток выявляли альциано- фильные вакуольные включения. В основном веществе стромы собственной пластинки слизистой оболочки происходило накопление гексозаминоглика- нов (ГАГ), о чем свидетельствовало повышение интенсивности сине-зеленого цвета при окрашивании АС. ГАГ, обладая гидрофильными свойствами, при накоплении обусловливали повышение тканевой и сосудистой проницаемо- сти ткани хозяина и паразита. Развивалась гидратация, которая приводила к выраженному мукоидному набуханию основного межуточного вещества соб- ственной пластинки слизистой оболочки. Местами мукоидное набухание пе- реходило в фибриноидное. Деструкция основного вещества соединительной ткани и волокон после воздействия антитрема приводила к образованию фибриноида – сложного вещества из белков и полисахаридов распавшихся коллагеновых волокон и основного вещества. При окрашивании ТС эпителий кишечника давал толуидинофилию с метахроматическим эффектом. Ме- тахромазия свидетельствует о наличии в этом месте гиалуроновой кислоты, что обеспечивает явление клеточной проницаемости. Метахромазия соедини- тельной ткани при этом была не выражена, что указывает на деполимериза- цию гексозаминогликанов основного вещества; она выражалась на гистоло- гическом препарате выпадением нитей фибрина в виде фрагментов. Резуль- таты гистохимических реакций указывают на увеличение содержания ГАГ, исчезновение гликогена в кишечном эпителии и функциональные механизмы патоморфологии после лечения антитремом.
После лечения антитремом метахроматический эффект в зоне взаимо- действия паразита и хозяина не наблюдали. Это связано с тем, что в хромот- ропных структурах происходило замещение сольватной оболочки и соедине- ние антигельминтного препарата с анионными группами, что блокирует вза- имодействие субстрата с молекулами красителя. Метахроматический эффект проявлялся слабо или наблюдали атипичное окрашивание ткани хозяина без метахромазии. В углевод-белковом полимере межтканевого пространства происходило увеличение кислотных групп, имеющих сродство к основному красителю. На препаратах отмечали застудневание содержимого интерстици- альных пространств, разволокнение и фрагментацию волокнистой части соединительной ткани, проявляющих положительное окрашивание АС на гек- созаминогликаны. Желатинирование белково-полисахаридных структур по- нижает скорость движения веществ, поэтому на препаратах наблюдали набу- хание межуточного вещества, что приводило к незначительному обезвожива- нию тканевых волокон, которые сжимались, теряли свою форму.
Таким образом, микроморфологические, гистохимические и патоморфо- логические исследования слизистой оболочки тонкого кишечника овец под- тверждают то, что антитрем вызывает отек и пролиферативно-гиперпласти- ческие проявления в тканях органа, дистрофические изменения в эндостации хозяина при парамфистомозе овец, нарушая углеводный и белковый обмены.
Литература
1. Архипов И.А. Этапы создания антигельминтиков и перспективы разви- тия экспериментальной терапии гельминтозов животных в России // Рос. па- разитол. журнал. – М., 2007. – № 1. – С. 67–73.
2. Гузоев А.Х., Беккиев С.А. Эффективность новых лекарственных форм авертекса, ивермакса и аверсекта при нематодозах овец // Тр. Всерос. ин-та гельминтол. – М., 2007. – Т. 45. – С. 83–85.
3. Кармалиев Р.С. Гельминтозы крупного рогатого скота Западного Ка- захстана и меры борьбы с ними (эпизоотология, терапия, резистентность к антигельминтикам): Автореф. дис. ... д-ра вет. наук. – М., 2011. – 51 с.
4. Кошеваров Н.И. Эпизоотология парамфистомоза крупного рогатого скота в Центральной части Нечерноземной зоны России и меры борьбы с ним: Автореф дис. ... канд. вет. наук. – М., 1997. – 22 с.
5. Кошеваров Н.И. Эколого-эпизоотологические особенности трематодо- зов жвачных в Нечерноземье РФ и влияние антигельминтиков в системе «па- разит-хозяин»: Автореф дис. ... д-ра вет. наук. – М., 2012. – 49 с.
6. Кряжев А.Л., Бирюков С.А., Лемехов П.А. Об эколого-эпизоотической ситуации распространения фасциолеза и парамфистомоза крупного рогатого скота в Вологодской области // Матер. докл. науч. конф. Всерос. о-ва гель- минтол. РАН «Теория и практика борьбы с паразитарными болезнями». – М., 2010. – Вып. 11. – С. 124–131.
7. Пирс Э. Гистохимия. – М., 1962. – 962 с.
© 2015 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin. This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI)) and the Agreemnt of 12/06/2014 (CABI org / Human Sciences section)