Фауна, морфология и систематика паразитов
УДК 619:576.895.132
DOI:10.12737/13267
Поступила в редакцию 13.01.2015
Скачать статью в PDF формате
English version
МОРФОЛОГИЧЕСКАЯ И МОЛЕКУЛЯРНАЯ ХАРАКТЕРИСТИКА НЕКОТОРЫХ ВИДОВ НЕМАТОД СЕМЕЙСТВА PROTOSTRONGYLIDAE LEIPER, 1926
Кучбоев А. Э.1, Каримова Р. Р.1, Рузиев Б. Х.2 , Салахутдинов И. Б.3, Эгамбердиев Ш. Ш.3
1 Институт генофонда растительного и животного мира АН РУз 100053, Ташкент, ул. Богишамол, 232, e-mail: a_kuchboev@rambler.ru
2 Каршинский государственный университет, Карши, Узбекистан
3 Центр геномики и биоинформатики при АН РУз, МСВХ Уз и ассоциации «Uzpakhtasanoat», Ташкент
Реферат
Цель исследования – проведение морфологической и молекулярно-генетической идентификации и изучение филогенетической взаимосвязи среди видов протостронгилид.
Материалы и методы. Гельминтологический материал собирали от диких и домашних полорогих и наземных моллюсков рода Xeropicta в предгорно-горных зонах Узбекистана. Морфологию протостронгилид изучали методами Боева (1975) и Anderson (1978). Для определения вида нематод готовили временные препараты, обработанные глицерином. Личинок первой стадии изучали путем исследования проб фекалий животных с учетом длины, формы хвоста и размера тела. Для изучения морфологии личинок третьей стадии протостронгилид отделяли ножки у зараженных моллюсков Xeropicta candaсharica и помещали их в искусственный желудочный сок, где разрушался чехлик и освобождались инвазионные личинки. После определения видовой принадлежности половозрелых и личиночных стадий нематод материал хранили в отдельных пробирках с дистиллированной водой при низких температурах (- 20 ºС) или в 70%-ном этаноле для молекулярного анализа. В работе использованы микроскопы ML 2000 с цифровой камерой и Olympus CX31. Выделение ДНК, амплификацию и секвенирование проводили на автоматическом секвенаторе. Филогенетический анализ проводили при помощи програмного обеспечения ClustalX 2.0. Филогенетические деревья построены при помощи метода присоединения соседей NJ (Neighbor–Joining method). Для сравнения филогенетического анализа использованы нуклеотидные последовательности ITS-2 участка видов Protostrongylus rufescens (EU018485), P. shiozawai (AB478249), Ortostrongylus macrotis (EU018483), Cystocaulus ocreatus (EU018481) и Umingmakstrongylus pallikuukensis (AY648409), которые получены из Генбанка (NCBI GenBank).
Результаты и обсуждение. Обнаружены половозрелые нематоды четырех видов протостронгилид: Protostrongylus rufescens, P. hobmaieri, Spiculocaulus leuckarti и Cystocaulus ocreatus. ДНК четырех видов половозрелых протостронгилид и личинок была амплифицирована с использованием ITS-2 региона. Размер амплификатов у нематоды P. rufescens и P. hobmaieri составил 380 пар нуклеотидов (п. н.), S. leuckarti – 388, C. ocreatus – 399. По результатам филогенетического анализа и сравнения нуклеотидных последовательностей у Caprinae выявлено 5 видов протостронгилид: Protostrongylus rufescens, P. hobmaieri, Protostrongylus sp., Spiculocaulus leuckarti и Cystocaulus ocreatus. Морфологический и молекулярно-генетический анализ выявленных нематод позволяет провести их точную идентификацию.
Ключевые слова: Protostrongylidae, полорогие, моллюски, DNA, ITS-2, нуклеотидная последовательность.
Введение
Нематоды семейства Protostrongylidae Leiper, 1926 – своеобразная группа нематод, паразитов респираторной системы жвачных и зайцеобразных. В семействе протостронгилид к настоящему времени описано 60 видов, отдельные популяции которых зарегистрированы в Европе, Азии, Америке, Африке и Австралии [1–7]. В Узбекистане у полорогих зарегистрировано 15 видов паразитов [2–4].
В биологическом отношении нематоды семейства Protostrongylidae занимают особое положение среди родственных групп. Они в процессе эволюции на всех стадиях своего развития перешли к обитанию в условиях суши. Половозрелые нематоды паразитируют у наземных млекопитающих, а личинки развиваются в наземных моллюсках, выполняющих роль промежуточных хозяев. В организме этих моллюсков, развиваются личинки второй и третьей стадий [2, 3].
Данные по молекулярному анализу нематод этой группы ограничены. В частности, убедительных фактов, касающихся частичных последовательностей из малой и большой субъединицы рибосомальной ДНК у Protostrongylidae, не обнаружено [8]. Посредством ограниченного анализа последовательностей рибосомальных ДНК 18S и 28S, выделенных из представителей таксонов Strongylida, были выведены различия в монофилии протостронгилид внутри Metastrongylina [9]. Проведены анализы на более низких таксономических уровнях, исследующие как ядерные, так и митохондриальные локусы или конформационный полиморфизм. Уделялось внимание разработке диагностики применения в географически экстенсивных регионах [9–11] или оценке генетического разнообразия видов и популяций [12, 13]. На основе сравнений и сходства последовательностей второго внутреннего транскрибирующего спейсера (ITS-2) были идентифицированы виды 7 родов протостронгилид, эндемичных для Северной Америки [11].
Дифференцированный анализ с использованием молекулярных маркеров (ядерных и митохондриальных) является крайне важным вкладом в изучении полевых коллекций взрослых паразитов и личинок. Корреляция молекулярных последовательностей между взрослыми (подтвержденной сравнительной морфологией) и личиночными стадиями паразитов приведет к первоначальной точной идентификации видов рода Protostrongylus и других протостронгилид. К настоящему времени не удалось обнаружить достоверных диагностических морфологических признаков сходства в строении личинок первой стадии (L1 – в фекалиях и окружающей среде) и личинок второй и третьей стадий (L2, L3 – в промежуточном хозяине) [3, 11].
Целью наших исследований было проведение морфологической и молекулярно-генетической идентификации и изучение филогенетической взаимосвязи среди видов протостронгилид.
Материалы и методы
Гельминтологический материал собирали от диких (Capra sibirica, C. falconeri, Ovis vignei и O. ammon) и домашних (C. hircus и O. aries) полорогих и наземных моллюсков Xeropicta candaсharica в предгорно-горных зонах Наманганской, Ташкентской, Джизакской и Сурхандарьинской областей Узбекистана.
Для изучения морфологии протостронгилид использовали методы Боева [2] и Anderson [7]. Для определения таксономической принадлежности этих нематод готовили временные препараты, обработанные глицерином.
Личинок первой стадии (L1) изучали путём исследования проб фекалий диких и домашних полорогих. При этом учитывали морфологические признаки личинок без дорсального кутикулярного шипа у вершины хвоста (для видов Protostrongylinae) и с шипом (для видов Muelleriinae, Varestrongylinae и др.), а также длину и форму хвоста и размеры тела.
Для изучения личинок третьей стадии (L3) протостронгилид отделяли ножки у зараженных моллюсков X. candaсharica и помещали их в искусственный желудочный сок, где разрушался чехлик и освобождались инвазионные личинки.
После определения видовой принадлежности половозрелых и личиночных стадий нематод материал хранили в отдельных пробирках с дистиллированной водой при низких температурах (- 20 ºС) или в 70%-ном этаноле для молекулярного анализа.
В работе использованы микроскопы ML 2000 с цифровой камерой и Olympus CX31.
Для изучения филогенетических взаимодействий протостронгилид использовали частичные нуклеотидные последовательности рибосомальной ДНК (ITS2).
Реакцию ПЦР проводили с использованием геномной ДНК в концентрации 10 нг, 2,5 мкл 10 × Taq буфера, 0,2 мкл дНТФ (нуклеиновые трифосфаты ДНК), 25 Ммоль каждая, 5 пикомоль/мкл праймера, где прямой праймер ITS- 2 F (5`-ACGTCTGGTTCAGGGTTGTT-3`) и обратный ITS-2 R (5`-TTAGTTTCTTTTCCTCCGCT-3`), 0,2 мкл Taq полимеразы (5 ед./мкл), воды до 25 мкл в следующем температурном режиме: 94 ºC в течение 30 c, 40 циклов (94 ºC в течение 10 с, 55 ºC 30 с, 72 ºC в течение 30 с) и финальная амплификация: 72 ºC в течение 10 мин. ПЦР продукты очищали при помощи кита «DNA Clean & ConcentratorTM–5». Секвенирование осуществляли на автоматическом секвенаторе (ABI 3730xl) в Европейском геномном и диагностическом центре «GATC Biotech AG» (Konstanz, Германия).
Полученные последовательности образцов нематод были исправленны и выравнены при помощи програмного обеспечения «Sequencher 4.9». В качестве контролей использовали референтные последовательности из базы данных NCBI (http://www.ncbi.nlm.nih.gov/).
Филогенетический анализ проводили при помощи програмного обеспечения ClustalX 2.0 [14]. Филогенетические деревья были построены при помощи метода присоединения соседей NJ (Neighbor–Joining method).
Для сравнения филогенетического анализа использовали нуклеотидные последовательности ITS-2 участка видов Protostrongylus rufescens (EU018485), P. shiozawai (AB478249), Ortostrongylus macrotis (EU018483), Cystocaulus ocreatus (EU018481) и Umingmakstrongylus pallikuukensis (AY648409), которые получены из Генбанка (NCBI GenBank).
Результаты и обсуждение
В результате проведенных исследований у домашних и диких животных обнаружены половозрелые нематоды четырех видов протостронгилид: Protostrongylus rufescens (Leuckart, 1865), P. hobmaieri Cameron, 1934, Spiculocaulus leuckarti Schulz, Orlow et Kutass, 1933 и Cystocaulus ocreatus (Railliet and Henry, 1908).
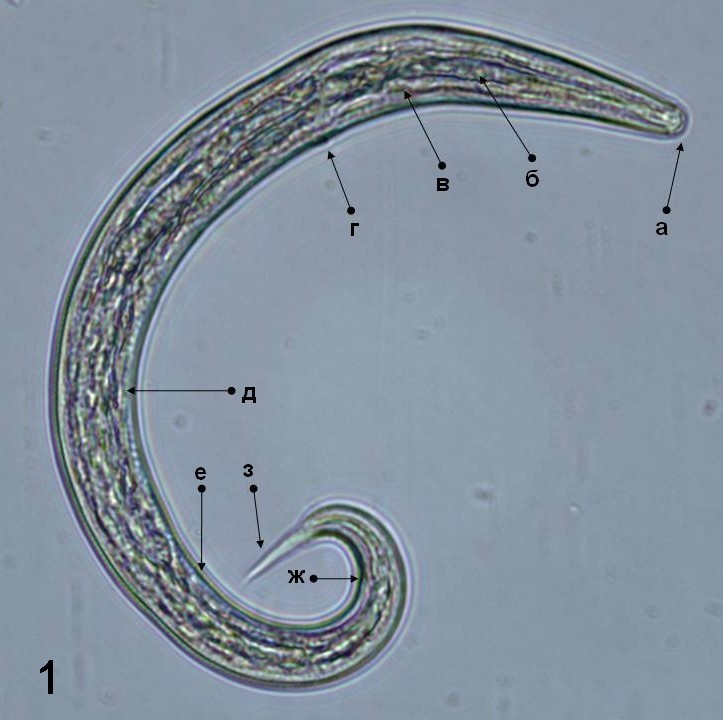
Изучено морфологическое строение L1 Protostrongylus sp., выделенных из фекалий коз (рис. 1). Личинки протостронгилид L1 с экскрементами выделяются из организма дефинитивного хозяина. Они, в общих чертах, очень схожи по морфологии [3, 10]. Тело личинок покрыто двухконтурной, слегка исчерченной кутикулой. Терминально расположенное ротовое отверстие ведет в ротовую капсулу. Пищевод цилиндрический, сзади слегка расширенный. Его длина равна почти половине всей длины личинки.
Длина тела личинок колеблется в пределах 306–380, а ширина – 19–24 мкм (рис. 1). Нервное кольцо окружает пищевод. Ближе к его середине, на вентральной стороне, открывается экскреторное отверстие. Кишечник переходит в тонкий ректум и заканчивается анальным отверстием. Между кишечником и кутикулой, в задней части тела личинки, лежит половой зачаток. Он имеет овальную форму и состоит из двух клеток. Задний конец тела личинки заканчивается заостренным хвостом.
Указанные личинки характеризуются отсутствием дорзального кутикулярного шипа у вершины хвоста. Анализируя морфологические признаки можно констатировать то, что эти личинки принадлежат одному из родов подсемейству Protostrongylinae Kamensky, 1905. Для подтверждения этого предположения проведены молекулярно-генетические исследования.
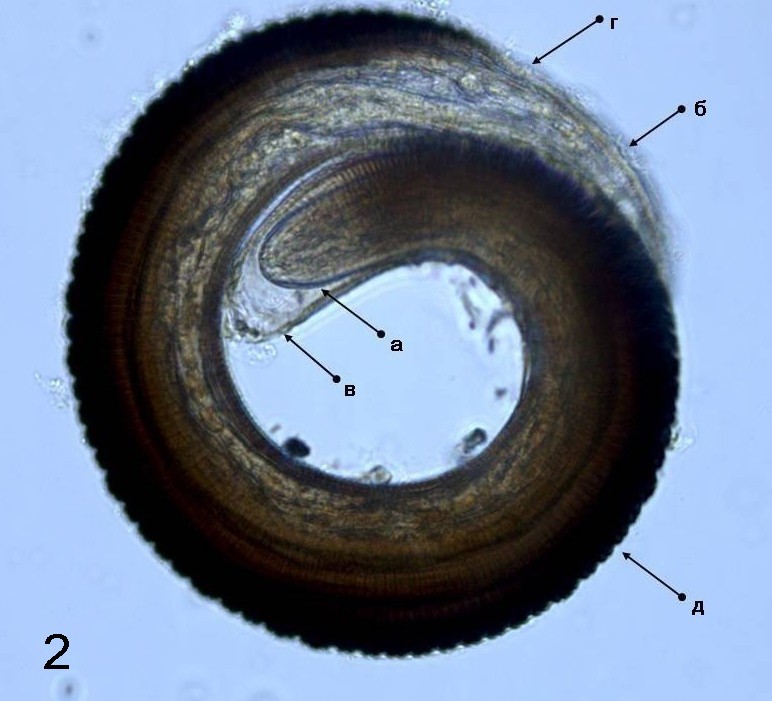
На рисунке 2 показана L3 с темно-коричневым ребровидным чехликом, изолированная из моллюска X. сandaсharica. Морфология L3 протостронгилид в промежуточном хозяине коренным образом отличается от L1.
Длина тела L3 – 682–690, ширина – 55–60 мкм (рис. 2).
|
|
|
|
|
Рис. 1. Микрофотография личинки первой стадии Protostrongylus sp. (увеличение 400 ×): a – головной конец; б – пищеводно-кишечный переход; в – нервное кольцо; г – экскреторное отверстие; д – кишечник; е – половой зачаток; ж – анус; з – хвост
|
Рис. 2. Личинки третьей стадии протостронгилид, извлеченные из ноги моллюска (увеличение 400 ×): а – головной конец; б – хвостовой конец; в–г – хитинизированные бороздки на головной и хвостовой частях личинки; д – панцирь |
|
Дифференциация L3 осуществляется после формирования чехлика. После освобождения от чехлика личинка малоподвижна, а ее внутренняя структура аналогична другим видам инвазионных личинок протостронгилид.
ДНК 4 видов половозрелых протостронгилид и образцов личиночных стадий была амплифицирована с использованием ITS-2 региона. Размер амплификатов анализировали при помощи гель-электрофореза в 1,5%-ном агарозном геле. Было выявлено, что размер амплификатов у нематоды P. rufescens и P. hobmaieri составляет 380 пар нуклеотидов (п. н.), S. leuckarti – 388, C. ocreatus – 399. L3 имеет одинаковый молекулярный размер, аналогичный видам нематод рода Protostrongylus и составляет 380 п. н. А L1 домашних коз (без кутикулярного шипика у вершины хвоста) имеет около 400 п. н.
Амплификаты были очищены и секвенированы на генетическом анализаторе. Полученные нуклеотидные последовательности были сравнены с опубликованными последовательностями региона ITS-2 при помощи BLAST международного генетического банка NCBI (blast.ncbi.nlm.nih.gov). Оказалось, что определенная нами последовательность (кроме вида P. rufescens) не была ранее депонирована в электронную базу данных GenBank и является новой для нее. Сиквенсы, полученные в ходе исследования, депонированы в NCBI GenBank (табл. 1). Было выявлено что последовательности L3 протостронгилид коррелировали с данными NCBI, так же идентифицирован вид личинок, как P. rufescens. Этот факт подтверждает материал, приведенный в филограмме (рис. 3). В то время как для L1 Protostrongylus sp., соответствующий вид в Генбанке не найден и он пока аналогичен с родом Protostrongylus.
|
Вид нематод
|
Стадия
|
Образец
|
Регистрированные номера в GenBank |
| Protostrongylus rufescens | Имаго | AK1a | KF811499 |
| P. rufescens | Имаго | AK4 | KF811498 |
| P. rufescens | Имаго | AK5 | KF811497 |
| P. rufescens | Имаго | AK7a | KF811495 |
| P. rufescens | L3 | AK16a | KF811494 |
| P. rufescens | L3 | AK17a | KF811493 |
| P. hobmaieri | Имаго | AK8 | KF811491 |
| P. hobmaieri | Имаго | AK13 | KF811492 |
| P. hobmaieri | Имаго | AK23 | KF811490 |
| P.hobmaieri | Имаго | AK26 | KF811489 |
| Spiculocaulus leuckarti | Имаго | AK14a | KF811488 |
| Protostrongylus sp. | L1 | AK19b | KF811500 |
| Cystocaulus ocreatus | Имаго | AK2a | KF811487 |
| Metastrongylus elongatus | Имаго | AK29 | KF811486 |
Филогенетический анализ с использованием метода NJ 19 образцов нематод различных видов позволил распределить их на 3 различных кластера (рис. 3). В качестве корневого образца был использован образец Metastrongylus salmi (Gedoelst, 1923). Первый кластер представлен образцом M. salmi (отличающийся на 18 % от второго и третьего кластеров). Второй кластер представили образцы P. shiozawai, Protostrongylus sp., S. leuckarti, O. macrotis, P. hobmaieri и P. rufescens, оказавшиеся довольно близкими видами на генетическом уровне. Третий кластер включал в себя виды C. ocreatus и U. pallikuukensis, показывающие также близкое генетическое родство.
Второй кластер также можно разделить на пять различных групп: группа 1 – P. shiozawai и Protostrongylus sp. показывающие близкое генетическое родство, 2 – S. leuckarti, 3 – O. macrotis, 4 – представители P. hobmaieri и 5 – представители P. rufescens.
По результатам проведенных исследований у Caprinae выявлено 5 видов протостронгилид: P. rufescens, P. hobmaieri, Protostrongylus sp., S. leuckarti и C. ocreatus. Морфологический и молекулярно-генетический анализ выявленных нематод позволяет провести их точную идентификацию, в том числе эндемичных протостронгилид.
Результаты этих исследований позволяют расширить взгляды по затронутой проблеме и способствуют идентификации географических разновидностей паразитов.
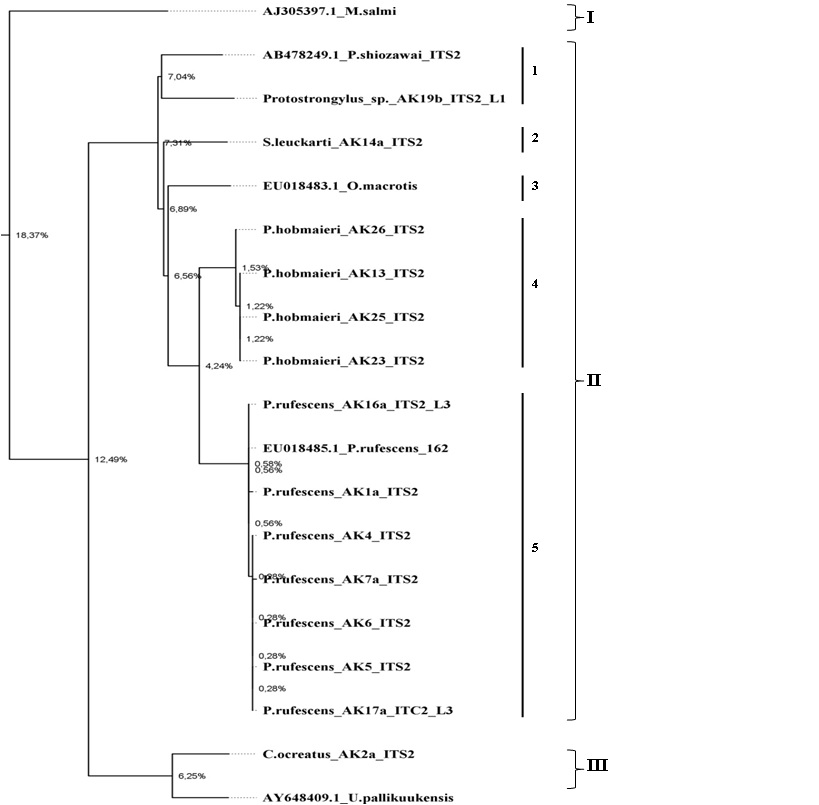
Рис. 3. Укоренённое филогенетическое дерево, построенное при помощи метода NJ (1000 повторений) для 19 образцов нематод различных видов. В качестве корневого вида был использован образец нематод Metastrongylus salmi
Литература
1. Азимов Д. А., Акрамова Ф. А., Хусанов А., Кучбоев А. Э. Структура и функционирование нематод семейства Protostrongylidae Leiper,1926 // Докл. АН РУз. – Ташкент, 1998. – №10. – С. 39–41.
2. Боев С. Н. Основы нематодологии. Протостронгилиды. – М.: Наука, 1975. – Т. 25. – 266 с.
3. Контримавичус В. Л., Делямуре С. Л., Боев С. Н. Основы нематодологии. Метастронгилоидеи домашних и диких животных. – М.: Наука, 1976. – Т. 26. – 239 с.
4. Кулмаматов Э. Н., Исакова Д. Т., Азимов Д. А. Гельминты позвоночных горных экосистем Узбекистана. – Ташкент: Фан, 1994. – 151 с.
5. Кучбоев А. Э. Популяционная экология, систематика нематод семейства Protostrongylidae Leiper, 1926 и функционально-метаболические процессы в системе “паразит–хозяин”: Автореф. дис... д-ра биол. наук. – Ташкент, 2009. – 43 с.
6. Рузиев Б. Х. Ассоциативная инвазия протостронгилидами овец и морфо-функциональные взаимоотношения в системе «паразит–хозяин»: Автореф. дис. … канд. биол. наук. – Ташкент, 2008. – 21 с.
7. Anderson R. C., Chabaud A. G., Willmott S. Key to genera of the superfamily Metastrongyloidea. – No. 5. CIN Keys to the nematode parasites of vertebrates. – Commonwealth Agricultural Bureaux, Farnham Royal, UK. – 1978. – Р. 1–40.
8. Carreno R. A., Nadler S. A. Phylogenetic analysis of the Metastrongyloidea (Nematoda: Strongylida) inferred from ribosomal RNA gene sequences // J. of Parasitology. – 2003. – Vol. 89. – P. 965–973.
9. Chilton N. B., Huby–Chilton F., Gasser R. B., Beveridge I. The evolutionary origins of nematodes within the order Strongylida are related to predilection sites within hosts // Molecular Phylogenetics and Evolution. – 2006. – Vol. 40. – P. 118–128.
10. Jenkins E. J., Appleyard G. D., Hoberg E. P. et al. Geographic distribution of the muscle-dwelling nematode Parelaphostrongylus odocoilei in North America, using molecular identification of first stage larvae // J. of Parasitology. – 2005. – Vol. 91. – P. 574–584.
11. Kutz S. J., Asmundsson I., Hoberg E. P. et al. Veitch ASerendipitous discovery of a novel protostrongylid (Nematoda: Metastrongyloidea) in caribou (Rangifer tarandus), muskoxen (Ovibos moschatus) and moose (Alces alces) from high latitudes of North America based on DNA sequence comparisons // Canadian J. of Zoology. – 2007. – Vol. 85. – P. 1143–1156.
12. Mortenson J. A., Abrams A., Rosenthal B. et al. Parelaphostrongylus odocoilei in Columbian black-tailed deer from Oregon // J. of Wildlife Diseases. – 2006. – Vol. 42. – P. 527–535.
13. Asmundsson I., Mortenson J., Hoberg E. P. Muscleworms, Parelaphostrongylus andersoni (Nematoda: Protostrongylidae), discovered in Columbia white-tailed deer from Oregon and Washington: Implications for biogeography and host associations // J. of Wildlife Disease. – 2008. – Vol. 44. – P. 16–27.
14. Larkin M. A., Blackshields G., Brown N. P. et al. Clustal W and Clustal X version 2.0. // Bioinformatics. – 2007. – Vol. 23. – P. 2947–2948.
© 2015 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin.
This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI) and the Agreement of 12.06.2014 (CABI.org / Human Sciences section).