Биохимия, биотехнология и диагностика
УДК 616:619.995.121:1-07
DOI:
Поступила в редакцию 12.05.2014
Принята в печать 14.01.2015
Скачать статью в PDF формате
English version
Динамика некоторых физико-химических свойств слюны при
оперативном лечении альвеококкоза печени
А. К. Мартусевич1, О. Б. Жданова2, В. А. Янченко2
1Приволжский федеральный медицинский исследовательский центр
Нижний Новгород, Верхневолжская Набережная, 18,
e-mail: cryst-mart@yandex.ru
2Кировская государственная медицинская академия
610998, Кировская область, г. Киров, ул. К. Маркса, 112
Реферат
Уточнена динамика кристаллогенной и инициирующей активности слюны пациентов с альвеококкозом при проведении оперативного лечения и в отдаленном послеоперационном периоде. Исследованы образцы слюны 22 пациентов с диагнозом альвеококкоз в Кировском зональном гепатологическом центре. Диагноз ставили на основании ультразвукового исследования, компьютерной и/или магнитно-резонансной томографии и лабораторных (латекс-агглютинации, ИФА) тестов. Всем больным выполнены оперативные вмешательства, которые они успешно перенесли. Кристаллогенные свойства слюны оценивали с использованием метода тезиокристаллоскопии с критериальным описанием фаций. Также проведено спектрометрическое исследование кристаллоскопических и тезиграфических фаций слюны. Установлено, что оперативное лечение альвеококкоза печени приводит к частичной нормализации кристаллогенных и инициирующих свойств слюны уже к моменту выписки из стационара.
Ключевые слова: альвеококкоз, печень, оперативное лечение, кристаллизация, слюна, биокристалломика.
Введение
Известно, что существует большая группа больных с очаговыми заболеваниями печени, которых на основании данных эксплоративных лапаротомий или паллиативных вмешательств признали радикально «неоперабельными» [1–4]. Это относится как к злокачественным, так и доброкачественным опухолям и паразитарным болезням.
Ранее при повторных операциях на печени ограничивались иссечением или выскабливанием свищей, вскрытием гнойных полостей, введением паразитотропных препаратов [4, 9, 10, 13]. В настоящее время появилась реальная возможность проводить повторные радикальные операции тем больным, которые раньше во время пробной лапаротомии или паллиативного вмешательства были признаны радикально «неоперабельными».
Принято считать, что первую радикальную резекцию печени после эксплоративной лапаротомии по поводу альвеококкоза выполнил Юдин (1929). Развитие хирургии способствовало тому, что большинство больных с очаговыми поражениями печени стали оперироваться не в специализированных учреждениях [9]. При этом многим из них вследствие технических осложнений и неправильной оценки операбельности очага поражения проводят паллиативные операции или эксплоративные лапаротомии, тем самым обрекая больных на инвалидность и неблагоприятный исход [3, 4, 10, 13, 15].
С 1964 г. был опубликован ряд работ отечественных хирургов, посвященных повторным операциям, в основном, при альвеококкозе печени [1–4]. Работами чл.-корр. РАМН В.А. Журавлева и других исследователей показано, что в хирургической гепатологии существует серьезная проблема оказания радикальной помощи «неоперабельным» больным с очаговыми поражениями печени [1–4, 9–11].
С другой стороны, важно полноценное диагностическое сопровождение оперативного лечения альвеококкоза. Применение современных инструментальных методов исследования морфологии печени (рентгенодиагностика с контрастированием, компьютерная и магнитно-резонансная томография, ультразвуковое исследование) позволяют с высокой степенью точности оценить характер, глубину и выраженность структурных нарушений органа, ассоциированных с развитием заболевания [12, 14–16]. Выраженность иммунного ответа на присутствие паразита может быть верифицирована с помощью реакций латекс-агглютинации, а также ИФА со специфическим альвеококковым диагностикумом [17]. Кроме того, сколексы альвеококка в некоторых случаях могут быть обнаружены в мокроте. В то же время, особенности метаболических сдвигов, в т. ч. изменения физико-химических параметров биологических жидкостей при альвеококкозе, его оперативном лечении и в послеоперационном периоде ранее практически не изучались. В этом плане нами было показано, что присутствие альвеококка существенно и направленно изменяет кристаллогенные свойства биосубстратов, причем характер данной трансформации приводит к однотипным сдвигам кристаллостаза слюны и мочи [6–8].
В связи с вышеперечисленным, представляет значительный научный и практический интерес уточнение динамики кристаллогенной и инициирующей активности слюны пациентов с альвеококкозом при проведении оперативного лечения, что и являлось целью данного исследования.
Материалы и методы
Материалом данного исследования послужили образцы слюны 22 пациентов, лечившихся по поводу альвеококкоза в Кировском зональном гепатологическом центре. Постановку диагноза верифицировали необходимыми инструментальными (ультразвуковое исследование, компьютерная и/или магнитно-резонансная томография) и лабораторными (латекс-агглютинация, ИФА) текстами. Всем больным выполнены оперативные вмешательства, которые они успешно перенесли. Получение биологической жидкости (смешанной слюны) проводили при поступлении в стационар и перед выпиской из него.
В течение 3 ч перед исследованием испытуемые не выполняли значительных физических нагрузок и не находились в состоянии психоэмоционального напряжения. Перед сбором биосреды обследуемые в течение 5 мин тщательно прополаскивали рот бидистиллированной водой в количестве 100 мл. Затем собирали ротовую жидкость (1 мл) методом сплевывания в чистые сухие пробирки.
Далее готовили микропрепараты по методу тезиокристаллоскопии, сочетающему исследование собственной кристаллообразующей активности смешанной слюны (классическая кристаллоскопия) и ее инициирующих свойств по отношению к одному базисному веществу (сравнительная тезиграфия) [5]. В качестве последнего в данной работе применялся 0,9%-ный раствор хлорида натрия.
Результаты кристаллоскопического и тезиграфического теста оценивали критериально с использованием собственной системы параметров [5, 7]. Она позволяет оценить общую кристаллизуемость (инициаторный потенциал – в отношении тезиграфии) биосубстрата, выраженность отдельных зон фации, степень деструкции кристаллических и аморфных элементов, равномерность их распределения по текстуре образца и др.
Данные визуальной морфометрии микропрепаратов высушенной РЖ дополнялись спектрометрическим исследованием кристаллоскопических и тезиграфических фаций, выполняемым на микроспектрофотометре PowerWave XS (США) при длинах волн 300, 350 и 400 нм [5] Для нивелирования влияния характеристик стекла на результаты спектрометрического исследования биокристаллов введена поправка на оптическую плотность самого материала (для кристаллоскопии) или контрольного образца базисного вещества, нанесенного на тоже стекло (для тезиграфического теста).
Статистическую обработку полученных данных проводили с помощью электронных таблиц Microsoft Excel 2007, а также с применением программы Primer of Biostatistics 4.03.
Результаты и обсуждение
С учетом того, что слюна является наиболее удобным неинвазивным маркером модификации физико-химических свойств и компонентного состава крови, а также биосубстратом, секретируемым в пищеварительном тракте – locus morbi альвеококкоза, и, следовательно, отражающим преимущественно его функционально-метаболический статус, изучение кристаллогенной активности данной биосреды представляло особый научно-практический интерес. На основании проведенных исследований установлено, что динамика различной степени выраженности имеет место по всем основным морфометрическим параметрам кристаллоскопических фаций слюны пациентов (рис. 1).
В частности, разнонаправленные изменения зарегистрированы в отношении непосредственных индикаторов результата дегидратационной структуризации биосреды – индекса структурности (ИС) и кристаллизуемости (Кр) компонентов биосубстрата. Так, исходно у больных, страдающих альвеококкозом, в микропрепаратах ротовой жидкости обнаруживали более сложные по характеру организации элементы – папоротникообразные дендритные кристаллы с ветвлением 3–4 порядка и выше, что отражается в нарастании уровня ИС относительно микропрепаратов слюны практически здоровых людей (Р < 0,05). Укрупнение основных структурных элементов фации слюны пациентов с альвеококкозом закономерно приводит к снижению плотности кристаллов, критериально регистрируемым в форме параметра Кр (Р < 0,05). В свою очередь, патологический характер выявленных сдвигов кристаллогенного потенциала рассматриваемого контингента больных отчетливо проявляется в динамике степени деструкции фации, практически достигающей 2 усл. ед., что соответствует выраженным нарушениям формирования кристаллических элементов с сохранением их дифференциации по типам.
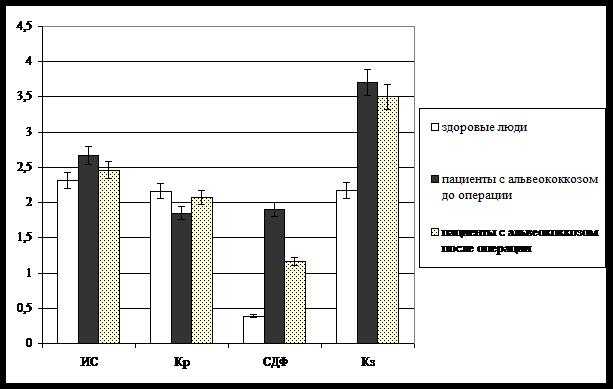
Рис. 1. Результат собственной кристаллизации ротовой жидкости пациентов
при оперативном лечении альвеококкоза
Известно, что в патогенезе альвеококкоза большое значение имеют не только механические свойства самого развивающегося в печени и других органах паразита, но и иммунологические реакции на его присутствие. Следовательно, в крови и, в меньшей степени, в других биосубстратах обнаруживается повышенная концентрация иммуноглобулинов, что приводит к нарастанию уровня белка в них. Маркером данных метаболических сдвигов в кристаллограммах слюны служит выраженность краевой зоны (Кз) микропрепарата, в которой концентрируются белковые макромолекулы при дегидратации. У пациентов с альвеококкозом исходно указанный показатель регистрировали в высоких цифрах, тогда как в норме он существенно ниже (Р < 0,05). В целом, до начала оперативного лечения кристаллогенные свойства слюны значительно отличались от кристаллоскопического «паттерна» практически здорового человека.
В раннем послеоперационном периоде кристаллогенные свойства изучаемой биосреды существенно трансформировались (рис. 1). Так, происходит практически полная нормализация параметров, характеризующих сложность структуропостроения и плотность распределения кристаллических элементов – ИС и Кр соответственно. Следует отметить, что эти показателя уже незначимо варьируют относительно контрольных значений, в то время статистически значимо отличаются от исходного уровня (Р < 0,05). Основной параметр, описывающий «правильность» кристаллогенеза – степень деструкции фации – также выражено снижается по сравнению с дооперационным кристаллоскопическим «паттерном», однако не достигает физиологического уровня.
Представляет интерес тот факт, что выраженность Кз микропрепаратов слюны после проведения операции изменяется в минимальной степени. По нашему мнению, данная тенденция связана с сохранением высоких концентраций антиальвеококковых антител в крови и, следовательно, в других биологических жидкостях. Это, в свою очередь, оказывает соответствующее влияние на параметр Кз, непосредственно зависящий от уровня белка. Таким образом, по завершению оперативного лечения у пациентов с альвеококкозом наблюдается частичная нормализация кристаллогенных свойств слюны.
Эти данные полностью подтверждаются верифицирующим методом – спектроскопическим исследованием кристаллоскопических фаций (рис. 2). С учетом того, что превалирующей тенденцией сдвигов кристаллогенных свойств слюны при альвеококкозе является укрупнение кристаллических элементов с увеличением сложности их построения, логичным представляется нарастание оптической плотности образца в целом при всех использованных длинах волны в дооперационном периоде относительно контрольных значений (Р < 0,05).
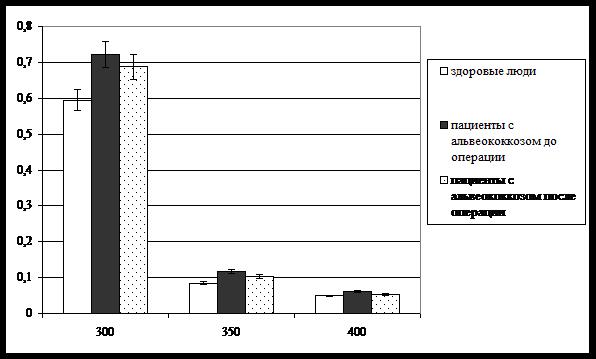
Рис. 2. Спектрометрический анализ кристаллоскопических фаций слюны
пациентов с альвеококкозом при проведении оперативного лечения
После проведения оперативного вмешательства уровень суммарной оптической плотности кристаллоскопической фации слюны снижается, однако остается значимо превышающим значения, характерные для практически здоровых людей (рис. 2). Следует отметить, что наиболее четко указанная динамика просматривается при спектроскопическом исследовании при λ=300 нм, менее выражена она при λ=350 нм, а при максимальной λ (400 нм) вследствие достаточно низких абсолютных значений она практически нивелируется.
Также нами проведен анализ инициаторных свойств слюны рассматриваемого контингента пациентов при проведении оперативного лечения (рис. 3). Выявлено, что основной показатель, характеризующий инициаторный потенциал биологической жидкости, – тезиграфический индекс (ТИ) – исходно находится на значимо более высоком уровне по сравнению с уровнем практически здоровых людей (Р < 0,05). По завершении оперативного лечения данный параметр умеренно снижается, однако эти сдвиги даже не носят статистической значимости. Аналогичная динамика зарегистрирована в отношении маркера сложности структуропостроения элементов – кристалличности (К), но послеоперационный уровень показателя уже недостоверно отличается как от исходных цифр, так и от физиологического тезиграфического «паттерна» слюны. Минимальные вариации среди основных тезиграфических показателей обнаружены для коэффициента поясности (Р) – критерия разброса молекулярных масс компонентов биосубстрата.
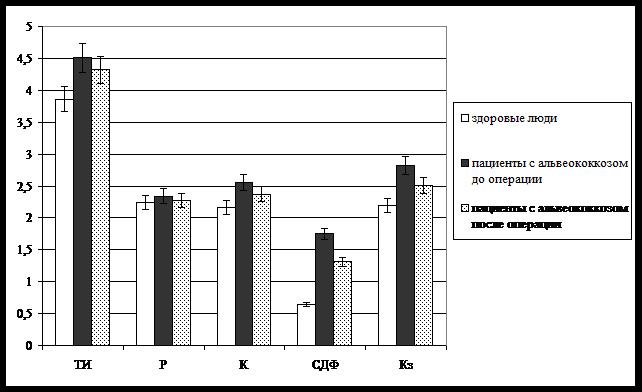
Рис. 3. Данные морфометрического анализа тезиграмм слюны при оперативном
лечении альвеококкоза
Эффективность проведенного оперативного вмешательства наиболее отчетливо проявляется в динамике главного тезиграфического критерия «правильности» протекания процессов структурообразования – степени деструкции фации, а также выраженности Кз микропрепарата (рис. 3). Эти показатели по завершению оперативного лечения статистически значимо снижаются относительно дооперационного уровня, однако не достигая цифр, характерных для практически здоровых людей (Р < 0,05). Данная тенденция косвенно свидетельствует о сохранности метаболических альвеококк-ассоциированных сдвигов состава и физико-химических свойств биологических жидкостей и после выполнения радикальной операции.
Указанные вариации полностью верифицированы результатами спектроскопического исследования тезиграфических фаций слюны пациентов в динамике оперативного лечения (рис. 4). В этом случае динамика суммарной оптической плотности тезиграмм очевидна при всех использованных длинах волны.
Таким образом, проведение оперативного лечения приводит к частичной нормализации физико-химических параметров и компонентного состава биологических жидкостей организма пациента уже к моменту выписки из стационара, что проявляется в динамике их кристаллогенных и инициирующих свойств.
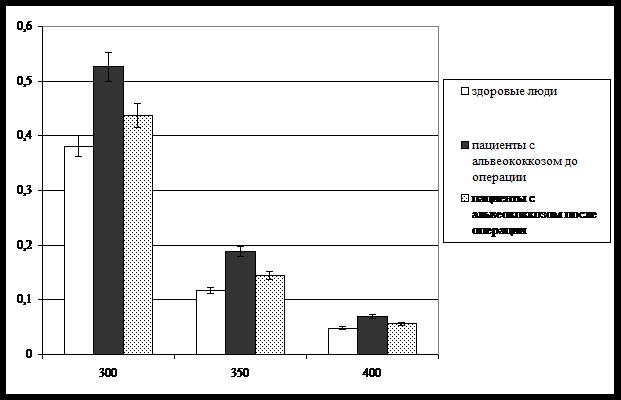
Рис. 4. Результаты спектрометрии тезиграфических фаций ротовой жидкости больных с альвеококкозом при выполнении оперативного лечения
Литература
1. Альперович Б. И. Альвеококкоз. – Якутск, 1967.
2. Веронский Г. И. Хирургическое лечение альвеококкоза печени // Анналы хирургической гепатологии. – 1997. – Т. 2. – С. 15–19.
3. Журавлев В. А. Альвеококкоз печени // Анналы хирургической гепатологии. – 1997. – Т. 2. – С. 9–14.
4. Журавлев В. А. Одномоментные и этапные радикальные операции у больных альвеококкозом печени, осложненным механической желтухой // Вестник хирургии. – 1980. – № 6. – С. 42–46.
5. Мартусевич А. К., Воробьев А. В., Зимин Ю. В., Камакин Н. Ф. Визуаметрия и спектрометрия в кристаллосалива-диагностике // Рос. стоматол. журнал. – 2009. – № 4. – С. 30–32.
6. Мартусевич А. К., Жданова О. Б., Янченко В. А. Патогенетическое значение изучения кристаллооб-разования биологических жидкостей при альвеококкозе // Анналы хирургической гепатологии. – 2006. – Т. 11, № 3. – С. 50–51.
7. Мартусевич А. К., Жданова О. Б., Янченко В. А., Камакин Н. Ф. Информативность изучения дегидратационных свойств биосред при альвеококкозе // Клин. лаб. диагностика. – 2006. – № 9. – С. 54.
8. Мартусевич А. К., Жданова О. Б., Написанова Л. А. Биокристалломика в паразитологии: современное состояние, возможности и перспективы // Рос. паразитол. журнал. – 2012. – № 4. – С. 77–88.
9. Мерзликин Н. В., Альперович Б. И., Парамонова М. М. и др. Повторные операции при очаговых заболеваниях печени // Хирургия. – 2011. – № 8. – С. 51–57.
10. Скрипенко О. Г., Шатверян Г. А., Багмет Н. Н. и др. Альвеококкоз печени: ретроспективный анализ лечения 51 больного // Хирургия. – 2012. – № 12. – С. 4–13.
11. Тумольская Н. И. Случаи альвеококкоза у человека в Европейской части России // Мед. паразитол. и паразит. бол. – 2010. № 3. – С. 45–47.
12. Черемисинов О. В. Возможности рентгеновской и магнитно-резонансной томографии в диагностике альвеококкоза печени // Мед. визуализация. – 2003. – № 4. – С. 46–52.
13. Gawor J. Potential risk factors for alveolar echinococcosis in humans in Poland // Przegl Epidemiol. – 2011. – V. 65, No. 3. – P. 465–470.
14. Gossios K. J. Uncommon locations of hydatid disease: CT appearances // Eur. Radiol. – 1997. – V. 7, No. 8. – P. 1303–1308.
15. Stefaniak J. Guidelines for diagnosis and treatment of liver alveococcosis caused by Echinococcus multilocularis // Wiad Parazytol. – 2007. – V. 53, No. 3. – P. 189–194.
16. Tsitouridis I., Dimitriadis A. S. CT and MRI in vertebral hydatid disease // Eur. Radiol. – 1997. – V. 7, No 8. – P. 1207–1210.
17. Wnukowska N., Salamatin R., Gołab E. Human echinococcosis in Poland in 2003–2010 according to the serological tests results of NIPH-NIH // Przegl. Epidemiol. – 2011. – V. 65, No. 3. – P. 455–458.
© 2015 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin.
This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI)) and the Agreemnt of 12/06/2014 (CABI org / Human Sciences section)