УДК 619:595.771:636.093
DOI:
Поступила в редакцию 06.11.14
Принята в печать 25.02.2015
Скачать статью в PDF формате
English version
Вспышки лигулеза у азовской тарани – одно ли эхо солнечных бурь?
Н. Д. Гайденок1, А. Е. Исачков2, О. В. Богус3
1Азовский научно-исследовательский институт рыбного хозяйства
344002, Россия, г. Ростов-на-Дону, ул. Береговая, д. 21, e-mail: ndgay@mail.ru
2 Южный научно-исследовательский институт рыбного хозяйства и океанографии, 298300, Россия, Крым, г. Керчь, ул. Свердлова, 2,
e-mail: info@yugniro.ru
3Южный научный центр РАН
344006, Россия, г. Ростов-на-Дону, пр. Чехова, 41, e-mail: ssc-ras@ssc-ras.ru
Реферат
Рассмотрены результаты моделирования инвазии гельминтов на примере азовской тарани. Показана связь вспышки с солнечной активностью и наличие хаотического характера динамики системы «паразит – хозяин».
Ключевые слова: азовская тарань, диграммоз, лигулез, система «паразит – хозяин», хаотическая динамика, аттрактор Лоренца.
Введение
Одной из проблем, возникающих при исследовании азовской тарани (АТ) Таганрогского залива и, к сожалению, на настоящий момент еще требующей своего окончательного разрешения, является «парадокс 3+», сущность которого состоит в том, что в уловах даже набором разноячеистых сетей особи возрастов, старших указанного порога, представлены в крайне незначительном количестве (рис. 1).
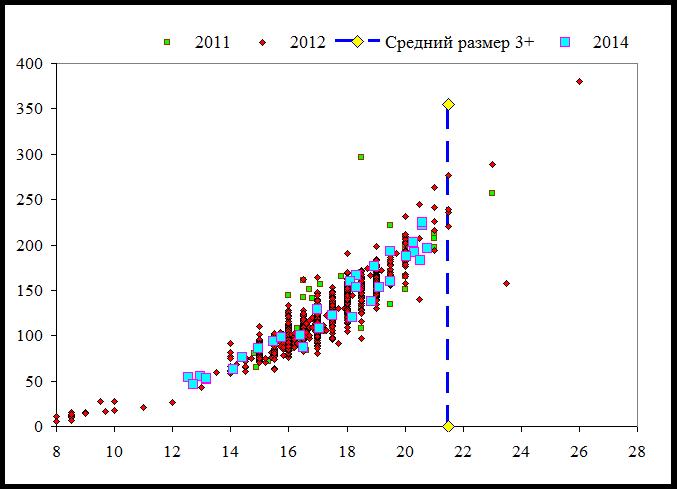
Рис. 1. Зависимость «пром_длина – вес» АТ
Для объяснения этого феномена в литературе предлагается, как правило, фактически одна причина – перелов. И действительно, опросы рыбаков показывают падение размера ячеи сетей, используемых при ловле тарани в период 1990–2005 гг. с 45 до 30 мм. Поэтому, здесь возникает коллизия – в настоящий момент в сети с ячеей 45 и 30 мм, стоящие рядом, тарань попадает только в сеть с 30 мм. Это говорит о том, что существует некий, доселе не известный, фактор, определяющий особенности результатов исследований, показанных на рис. 1.
Материалы и методы
В качестве материалов были использованы, как сведения, содержащиеся в литературе [5, 6], так и результаты нашего ихтиомониторинга [4]. При решение поставленной проблемы были использованы методы математического моделирования [3].
Результаты и обсуждение
Для идентификации природы данного фактора целесообразно привлечь следующие экосистемные факты, как постоянное присутствие, так и вспышка диграммоза в 2012 г. в Таганрогском заливе при 100%-ной эффективности инвазии для возраста АТ 1+ [7]. Причем, наличие ремнецов регистрируют даже два года спустя – зараженность АТ, определяемая даже по наличию развитых гельминтов, в 2014 г. для возрастов 2+ и старше достигает 50 %.
Аналогичная картина наблюдается и по лещу [6], где имеется цикличность в развитии паразитов (разные виды) приблизительно в 4 года, причем, спустя 2 года после пика эффективность инвазии находится на уровне 20–60 %. Для АТ это находит свое подтверждение регистрации условно здоровой фракции в 2004 и 2007 гг. [5].
Особенности жизненного цикла представителей данного семейства освещены в литературе [1, 7, 8). В виду того, что основные особенности жизненных циклов возбудителей гельминтоза у рыб ленточных паразитов (ремнецов), относящихся к классу цестод (Cestoidea), отряду лентецов (Pseudophyllidea), семейству (Ligulidae) и родам Ligula и Digramma совпадают, то анализ будем проводить, используя термин лигулез, как наиболее распространенный.
Половозрелый паразит локализируется в кишечнике птиц-ихтиофагов. К ним относятся различные виды чаек, поганок, цапель, бакланов, домашняя утка и курица, ворона, голуби, некоторые пернатые хищники.
Яйца лигулы имеют овальную форму; длина их 45–50, ширина 31–33 мм. На одном из полюсов имеется отверстие, через которое личинка (корацидий) выходит в воду. Массовый выход личинок наблюдается через 5–6 сут при температуре воды 25 °С. Благодаря наличию ресничек личинка плавает в воде и может жить в свободном состоянии до двух суток. Для дальнейшего сохранения и продолжения жизни она должна попасть в организм промежуточного хозяина – циклопа, где личинка претерпевает большие изменения, прежде всего теряет ресничный покров, увеличивается в размерах и скоро превращается в зрелого процеркоида с мешковидным отростком на заднем конце. Через 9–10 сут с момента попадания в организм циклопа процеркоид становится инвазионной формой, в случае заглатывания его рыбой наступает заражение. Если же в течение 3–5 сут зараженный рачок не будет съеден рыбой, то личинка паразита в его теле гибнет.
В кишечнике рыбы промежуточный хозяин (рачок) под влиянием пищеварительных ферментов переваривается, а процеркоид проникает в стенку кишечника и током крови заносится в брюшные мышцы, а затем попадает непосредственно в брюшную полость. Здесь паразит превращается в третью стадию личинки, которая называется плероцеркоид. Инвазионной стадии плероцеркоид достигает через 12–14 мес. В организме рыбы лигула в стадии плероцеркоида может жить 2–3 года, что полностью соответствует общебиологическому характеру сохранения жизнеспособности семян – одни всходят в тот же год, а другие могут и через 5–10 лет.
Когда плероцеркоид достигает больших размеров и оказывает давление на плавательный пузырь рыбы, то она поднимается к поверхности и плавает, выставляя горб или, вообще, лежит на боку. В быту таких особей, независимо от вида, называют «горбушей». Если на стадии «горбуши» рыба не поедается птицей, то она все равно погибает в осенне-зимний период, вмерзая в лед. И цепь при этом разрывается.
Одновременно с увеличением размера плероцеркоида в стробиле закладываются половые органы, но окончательно они не развиваются, так как для этого в организме рыб нет соответствующих условий.
Если в этот период рыба вместе с плероцеркоидом будет проглочена рыбоядной птицей, то в кишечнике последней лигула через 45–60 ч превращается в половозрелую форму и усиленно выделяет яйца в окружающую среду. Заражение птиц лигулезом наступает также при заглатывании изолированных зрелых плероцеркоидов, оказавшихся в воде после гибели рыбы.
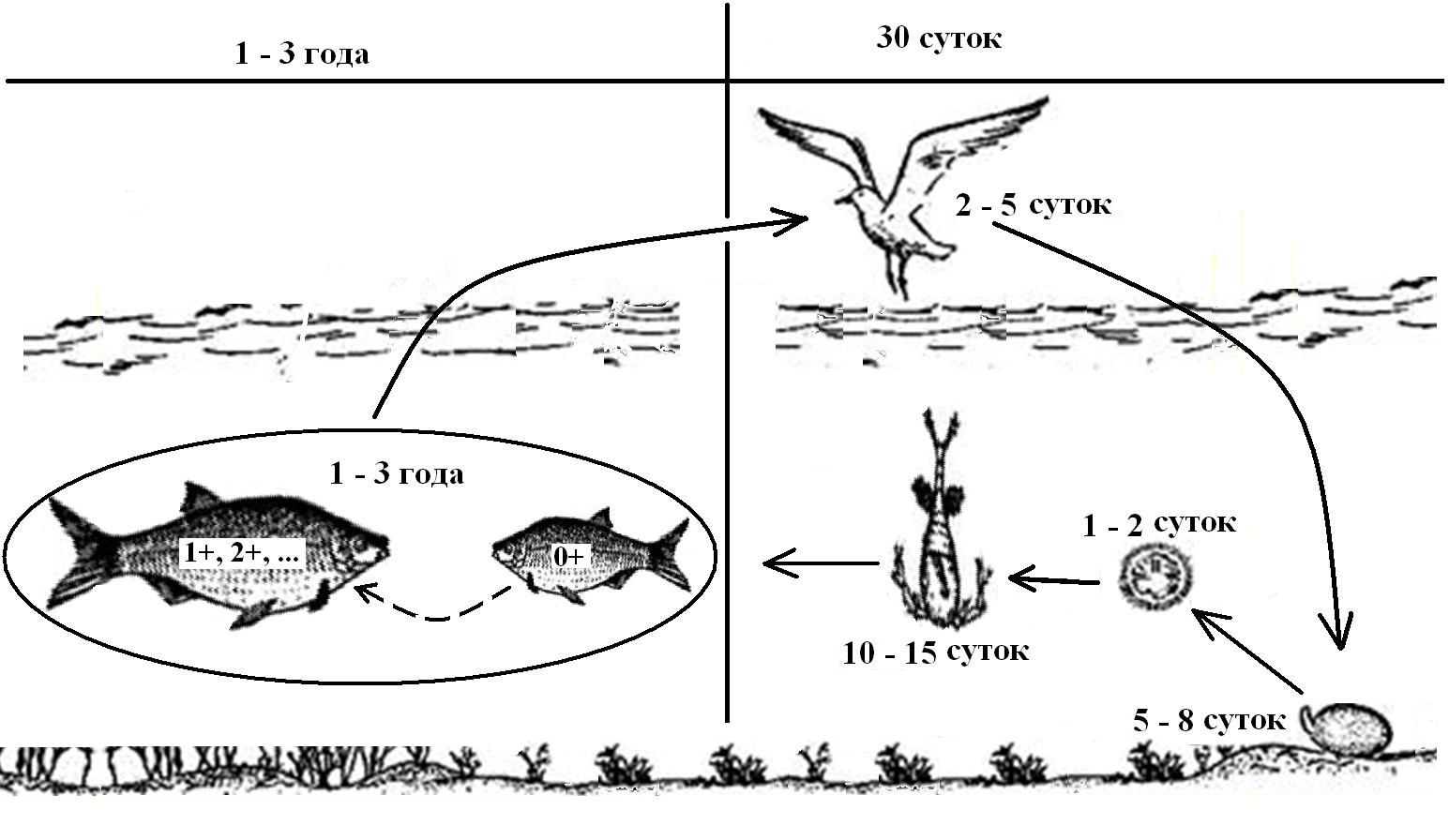
Рис. 2. Схема развития лигулеза рыб
Далее проанализировано соответствие жизненного цикла лигулы и особенностей питания АТ разных возрастов. Планктонное питание у АТ свойственно только сеголеткам, да и то на протяжении 1–3 мес. В виду того, что личинка АТ появляется в апреле (при позднем нересте – в начале мая), то взаимодействие в цепи «чайка – яйцо – личинка – зоопланктон – АТ» календарно может происходить только в период апреля–июня (июля). В более поздние сроки цепь разомкнута.
В соответствии с вышеизложенным, взаимодействие «АТ – чайка» может быть построено только на тех особях АТ, которые имеют плероцеркоид в период апреля–июня (июля), т. е. зараженных на протяжении 1–3 лет назад и перезимовавших. Это возраста 1+ - 3+. Факт наличия таких особей подтверждается результатами ихтиомониторинга 2014 г., когда в августе наблюдали инвазийные особи АТ возраста 2+ - 3+, имеющие степень ожирения от 2 до 4, при преобладании степени ожирения 3–4 (рис. 1). Что, в свою очередь, говорит о возможности участия таких особей как в передаче плероцеркоида чайке в следующем году, так и гибели от замерзания зимой.
Результаты анализа показывают, что привлечение фактора зараженности лигулезом, которое не может обусловить массовый терминальный возраст АТ в 3+ при потенциальной продолжительности жизни в 11–13 лет, в совокупности с чрезмерным переловом обусловливает регистрируемую в мониторинге биолого-демографическую структуру АТ.
Жизненный цикл лигулы (рис. 2) состоит из двух частей, имеющих различные скорости превращений. Правая часть (рис. 2), где содержатся 4 объекта, длится максимум месяц. На левой части, где происходит всего лишь жизненный цикл рыб, время превращения минимум на порядок, а в реальности – почти на 1,5 порядка (точнее в 12–36 раз) больше.
В связи с этим вся сложная цепь превращений может быть сведена к следующему простому процессу, описываемому оператором F(t), смысл которого достаточно прозрачен – сколько одна съеденная рыба старших возрастов через цепь превращений сможет заразить рыб возраста 0+ (рис. 3).
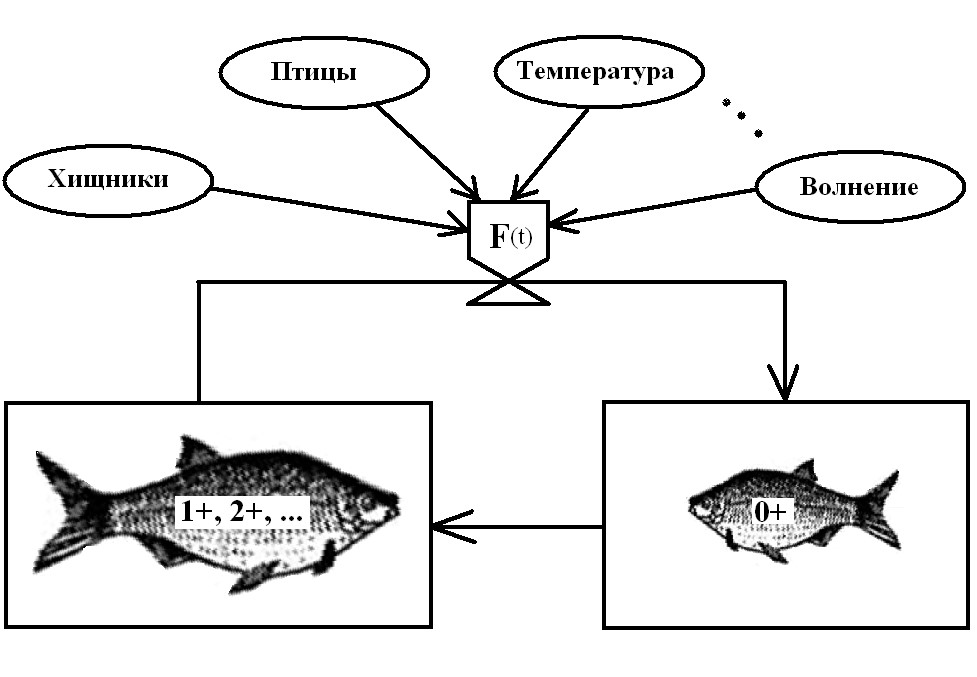
Рис. 3. Феноменологическая картина развития лигулеза рыб
Исходя из вышеизложенного, для обеспечения равновесия одна инвазированная рыба должна инвазировать, в среднем, одну здоровую. Но, если учесть срок созревания рыбы и наличие на этом возрастном интервале отхода, который усиливается инвазией, то интенсивность инвазии стоит увеличить с 1 рыбы до 3–5.
Оператор F(t) по мимо факторов, показанных на рис. 3, зависит еще от особенностей возрастной динамики в популяции рыб и множества известных (числа Вольфа) и не известных, прямо или опосредованно влияющих на цикл процессов.
В плане влияния чисел Вольфа, помимо многочисленных примеров из литературы по связи эпидемий с солнечной активностью, по отношению к АТ можно сказать следующее. В 2012 г. была вспышка диграммоза, имеющего практически одинаковые с лизулезом особенности развития; кроме того, в 2003 г. у леща была вспышка Caryophyllaeus latieceps. Cолнечная активность в 2003 и 2012 гг. была одинаковой (рис. 4).
Кроме того, если зима 2014–2015 гг. будет холодной (линия Р), то ввиду летней вспышки солнечной активности в 2014 г. с достаточной степенью вероятности можно ожидать также повторение сценария 2003 или 2012 гг.
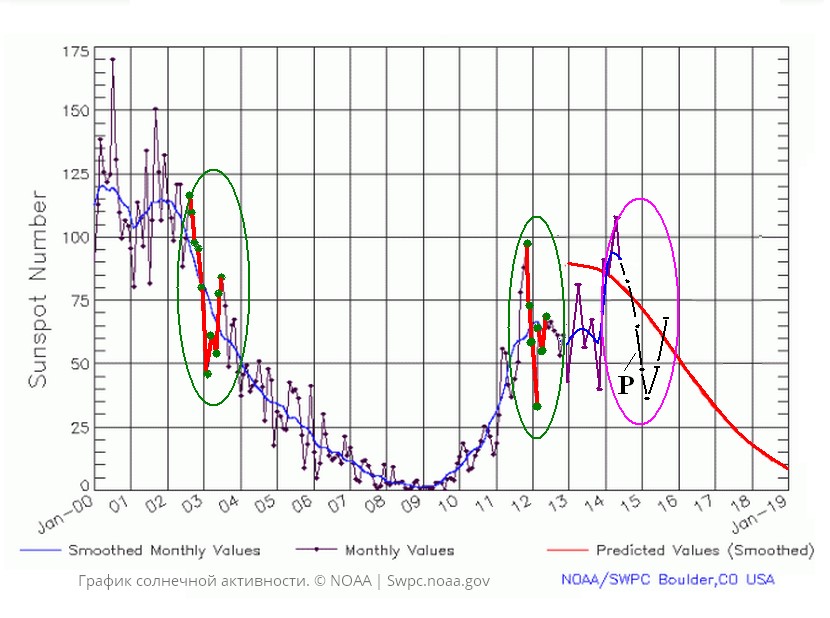
Рис. 4. Динамика солнечной активности
Экспериментальные исследования [8] позволяют констатировать: гельминтозы не являются чем-то исключительным в ихтиологии и наблюдаются довольно постоянно в различных водоемах при средней эффективности инвазии в 10–30 %. А показанная выше вспышка с позиций теории Чижевского [9], также чем-то исключительным не является – ее цикличность имеет период 9–13 лет.
Наличие разброса длины периода солнечной активности говорит, если не ее случайной природе, то, по крайней мере, о присутствии в нем случайной составляющей. Кроме того, период экстремумов первого порядка в ряде равномерно распределенных случайных чисел составляет 3–4, а экстремумов второго порядка (экстремумы экстремумов первого порядка) равен 9–13 [3] . Нет достаточных оснований отрицать случайный фактор в природе солнечной цикличности.
Данные факторы приводят к довольно неожиданной динамике процесса инвазии. Например, одна инвазированная рыба инвазирует уже не одну здоровую рыбу, а три или десять – кто может ответить в случае солнечной вспышки. Но что же будет происходить при условно постоянных величинах параметров, определяющих систему «паразит – хозяин»?
Для ответа на этот вопрос рассмотрим агрегированную «запас – пополнение» модель, построенную на знании экологических особенностей внутрипопуляционных взаимодействий, где ее параметры находятся в пределах нормативов на выживаемость различных возрастных классов ихтиофауны.
Для построения полной картины динамики необходимо половозрелую часть популяции разбить на две группы – инвазированную (I) и условно здоровую (Z). Возрастной класс 0+ (хозяин) обозначим (L).
Процесс инвазии имеет следующие особенности:
1. Он относится к третьему типу функциональной реакции хищника (в данном случае паразит) на численность жертвы (хозяина) и может быть формализован следующим выражением:
Доступное инвазии = mах (0, Численность – Пороговая численность)
или
L+ = max (0, L – Lp)
Меньше определенного порога численности, пусть даже самого минимального, но не нулевого, инвазии не происходит.
2. Конкретный объем инвазированных особей составляет только некоторую долю b от доступных к инвазии.
3. Одна половозрелая инвазировання рыба заражает a Î (0, N] здоровых 0+.
4. Фактическое число инвазированных особей FLi:
FLi = min (bL+, aI)
Далее, обозначив выживаемость L, I и Z, как sL, sI и sZ, а ИАП – рI, рZ, можем привести уравнения динамики
Lt+1 = sL(pIIt + pZZt)×max (e, 1 - (It + Zt)/K), e» 0,01 (1)
Zt+1 = sZZt + Lt – min ((bLt+, aIt)
It+1 = sIIt + min ((bLt+, aIt)
Согласно комплексу нормативов [2], положим границы интервалов для величин sLÎ [0,025, 0.1] (приводится, что в НВХ и до 0,16), sIÎ [0,085; 0,15] и sZÎ [0,3; 0,6]; средние значения для рI и рZ – 9 тыс. (минимальная ИАП) и 77 тыс.; b » 0,6 ¸ 0,8; aÎ [0,8; 22]. Для взаимосвязанных параметров К и Lp используем величины 33 тыс. и [0,2; 7] тыс.
Стоит обратить внимание на факт взаимосвязи параметров выживаемости и параметра a. Трудно утверждать, что при высоких значениях a, а это происходит, например, во время солнечной вспышки, величины выживаемости также будут иметь высокие значения или, наоборот.
При этом стоит отметить, что все особенности развития инвазии построены на том, что, если численность L превысит уровень Lp, то возникнет инвазия – чаек, циклопов-носителей, как правило, достаточно. Причем, превышение уровня Lp 0+ необязательно должно быть по всему морю – для этого будет достаточной концентрации их в локальном районе.
Кроме того, во время солнечной вспышки, как уровень Lp, так и величина b значительно повышаются.
Такими районами, в первую очередь, окажутся те, что расположены вблизи крупных населенных пунктов, где неизбежно находятся свалки мусора и пищевых отходов, на которых интенсивно кормятся чайки. В Таганрогском заливе и в непосредственной близости от него находятся такие города, как Бердянск, Мариуполь, Таганрог, Ростов/Д, Азов, Ейск.
На следующий год бывшие сеголетки уже в возрасте 1+ станут «горбушей» и будут съедены птицами, которые разнесут инвазию по окрестным акваториям – пойдет «цепная реакция» с той или иной эффективностью инвазии.
В исходном районе значительно сократится численность 1+, а выжившие особи будут носителями еще 1–2 года. Это существенно увеличит смертность возрастных классов 2+ - 3+ и уменьшит, если не сведет до нуля, их ИАП. Все это даст основу для колебаний численности, что подтверждено данными литературы [10].
В вышеприведенном множестве параметров системы (1) наблюдается довольно широкий спектр решений – от стационарной точки и квазипериодических колебаний до хаоса (рис. 5), что говорит о принципиальной возможности эндоколебаний численности и без воздействия солнечной активности.
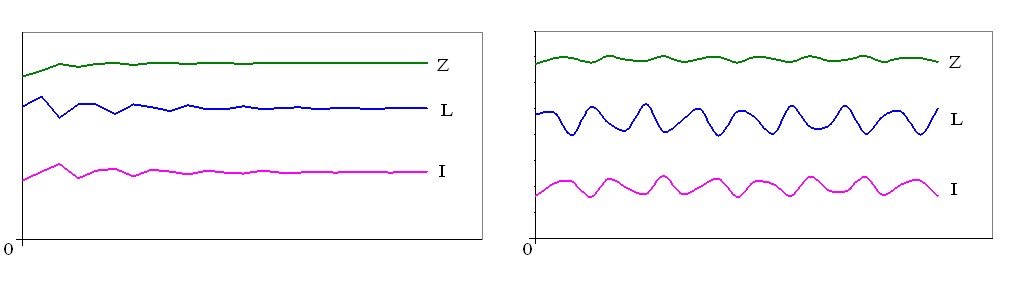
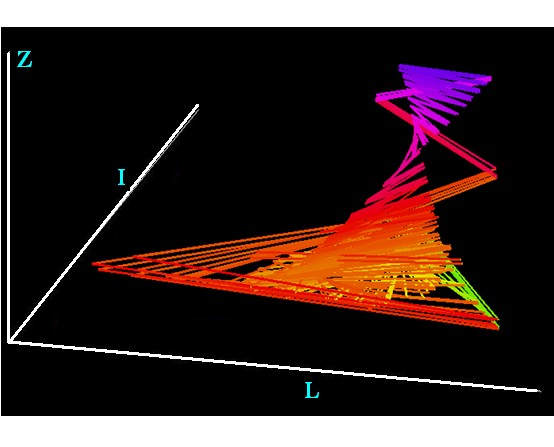
Рис. 5. Варианты динамики системы L, I и Z
Причем, эффективность инвазии для всех вариантов динамики системы L, I и Z вполне соответствует экспериментальным результатам [8] ~ 15 % для рис. 5.
Продолжая анализ вариантов динамики системы L, I и Z в зависимости от величин параметров модели, стоит отметить, что при sL< 0,033 (выживаемость «икра – сеголеток» у весенне-нерестующих рыб) никаких колебаний не происходит.
Хаос (рис. 5) происходит при sL ³ 0,08, Lp ~ 1,5, a ~ 11. Такое соотношение sL и a в обычных условиях, но не при солнечной вспышке, не характерно для природных популяций и может быть реализовано разве только на базе НВХ.
По своему геометрическому характеру хаотические особенности динамики системы L, I и Z качественно подобны аттрактору Лоренца – периодическое движение в разных плоскостях – «L–I»,«L–Z»и «Z–I» при перескоке между ними.
Заключение
Таким образом, циклический характер динамики в системе «АТ – гельминты» может происходить даже при отсутствии экзогенных факторов. А при их наличии несомненно увеличивается амплитуда колебаний.
Продолжительность жизни паразитов Digramma interrupta совпадает с массовым возрастом АТ в уловах, что, несомненно, говорит о существенном влиянии паразита на продолжительность жизни АТ.
Литература
1. Васильков Г. В., Гриченко Л. Л., Енгашев В. Г. Болезни рыб. – М.: Агропром, 1989.
2. Временная методика оценки ущерба, наносимого в результате строительства и проведения различных работ на рыбоводных водоемах. – М.: ВНИРО, 1990. – 60 с.
3. Гайденок Н. Д., Баранов А. Н., Чмаркова Г. М. Моделирование, экология и промысел ихтиофауны Енисея и Оби и морских млекопитающих Карского моря. – Красноярск, 2014.
4. Гайденок Н. Д., Богус О. В. Экосистемный характер биодемографических параметров азовской тарани // Матер. Междунар. конф. «Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России». – Ростов-на-Дону, 2014. – С. 31–37.
5. Матишов Г. Г., Гайденок Н. Д., Исаков А. Е., Лужняк В. А. Ареал распространения, характер миграции и популяционная структура азовской тарани // Матер. Междунар. конф. «Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России». – Ростов-на-Дону, 2014. – С. 47–53.
6. Матишов Г. Г., Пономарева Е. Н., Лужняк В. А., Старцев А. В. Результаты ихтиологических исследований устьевого взморья Дона. – Ростов-на-Дону, 2013.
7. Матишов Г. Г., Казарникова А. В., Куцин Д. Н. Вспышка численности плероцеркоидов Digramma Interrupta у азовской тарани // Вест. ЮНЦ. – 2013. – С. 53–60.
8. Новак А. И. Паразитофауна рыб в экологических условиях водоемов северной части верхневолжского региона: Автореф. дис. ... д-ра биол. наук. – М., 2010. – 44 с.
9. Чижеский А. Л. Земное эхо солнечных бурь. – М.: Мысль, 1976.
10. Nicholson A. J. An outline of the dynamics of animal populations // Aust. J. Zool. – 1954. – V. 2. – P. 9–65.
11. http://solarscience.msfc.nasa.gov/predict.shtml
© 2015 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin.
This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI)) and the Agreemnt of 12/06/2014 (CABI org / Human Sciences section)