English version
Эпизоотология, эпидемиология и мониторинг паразитарных болезней
УДК 576.895.122
DOI:
Поступила в редакцию 15.11.2015
Принята в печать 05.03.2016
Для цитирования:
Шакарбаев У.А., Акрамова Ф.Д., Азимов Д.А. Melanoides kainarensis - новый промежуточный хозяин трематоды Philophthalmus lucipetus (Trematoda, Philophthalmidae). // Российский паразитологический журнал. - М. - 2016. – Т. 36. -Вып.2 . - С. .
For citation:
Shakarbayev U.A., Akramova F.D., Azimov D.A. Melanoides kainarensis - new intermediate host of trematodes Philophthalmus lucipetus (Trematoda, Philophthalmidae), Russian Journal of Parasitology. M., 2016. Vol.36. Iss.2. pp..
MELANOIDES KAINARENSIS - НОВЫЙ ПРОМЕЖУТОЧНЫЙ ХОЗЯИН ТРЕМАТОДЫ PHILOPHTHALMUS LUCIPETUS (TREMATODA, PHILOPHTHALMIDAE)
Шакарбаев У.А., Акрамова Ф.Д., Азимов Д.А.
Институт генофонда растительного и животного мира АН РУз,
ул. Богишамол 232, Ташкент, 100053, Узбекистан, ushakarbaev@mail.ru
Реферат
Цель исследования – изучение зараженности моллюсков Melanoides kainarensis Starobogatov et Izzatullaev, 1980 церкариями трематоды Philophthalmus lucipetus (Rudolphi, 1819) в естественных условиях Узбекистана.
Материалы и методы. Исследованы церкарии и партениты Ph. lucipetus, из моллюсков M. kainarensis из теплого источника Бошховуз Самаркандской области Узбекистана. Морфологические и биологические исследования осуществлены известными паразитологическими методами.
Результаты и обсуждение. При исследовании 2801 экз. M. kainarensis оказались зараженными церкариями и партенитами рода Philophthalmus Looss, 1899, которые были идентифицированы и отнесены к виду Ph. lucipetus. Собранные церкарии и адолескарии использованы для экспериментального заражения Anser anser dom., Anas platyrhynchоs dom. и Gallus gallus dom. Взрослые паразиты, выделенные из конъюнктивального мешка зараженных птиц были определены как Philophthalmus lucipetus. Это первый случай, подтверждающий участие M. kainarensis в качестве промежуточного хозяина указанной трематоды.
Ключевые слова: Melanoides kainarensis, Philophthalmus lucipetus, партениты, церкарии, адолескарии, трематоды, птицы, моллюски.
Введение
Диапазон географического распространения Philophthalmus lucipetus (Rudolphi, 1819) достаточно широк. Популяции этой трематоды зарегистрированы во многих странах Европы, Азии, Африки и Америки у различных экологических групп птиц. Взрослые трематоды паразитируют в конъюнктивальном мешке и вызывают серьезное заболевание у сельскохозяйственных и охотничье-промысловых птиц. В странах СНГ данный вид зарегистрирован у Anser anser на территории Украины (Смогоржевская, 1976). Популяции Ph. lucipetus отмечены во многих странах у гусей, уток, кур, павлинов, индюков, страусов и нанду (Greve and Harrison, 1980; Mukaratirwa et al., 2005; Pinto, 2009). В качестве промежуточных хозяев этой трематоды указанными авторами были установлены моллюски Melanoides tuberсulatus, Fagotia acicularis, Amphimelania holandri, Melanopsis praemorsa, Pleurocerca acuta и Tarebia granifera (Alicata, 1962; Literak et al., 2013).
Взрослые формы Ph. lucipetus у птиц в естественных условиях Узбекистана пока не отмечены. Однако, нахождение церкарий у M. kainarensis, как нового промежуточного хозяина в Узбекистане и формирование очага инвазии только на одной территории настоятельно потребовали проведения настоящих исследований.
Целью данной работы является установление естественной инвазированности популяции M. kainarensis церкариями Ph. lucipetus в Узбекистане и воспроизведение жизненного цикла этой трематоды в условиях эксперимента.
Материал и методы
Материалом для настоящей работы послужили результаты фаунистических и экспериментальных исследований, выполненных в 2010 - 2015 гг. с целью изучения фауны и морфо - биологических особенностей церкарий, развивающихся в пресноводных моллюсках. Сбор моллюсков проводили по общепринятой методике (Жадин, 1952) из теплого родникового источника (Бошховуз в степи Карнабчуль Нурабадского района Самаркандской области). Этот теплый водоем интенсивно посещают водно-болотные птицы. Наблюдение проводилось стационарно с 2014 - 2015 г. исследовано 2801 экз. указанных моллюсков Melanoides kainarensis. Видовая диагностика проводилась по работам (Лихарев и Старобогатов, 1967; Старобогатов, Иззатуллаев, 1980). Собранные моллюски были доставлены в лабораторию, где их рассаживали индивидуально в стаканчики, содержащих по 50 мл водопроводной воды при температуре 20 - 25 °С. Наблюдения эмиссии церкарий проводилось визуально и с использованием бинокуляра МБС - 10.
Морфологию вышедших в воду церкарий изучали с использованием витальных красок - 0.05 % нейтрального красного и 0.05 % сульфата нильского (Гинецинская, 1968). Для окрашивания тотальных препаратов использовали уксуснокислый кармин.
Для воспроизведения жизненного цикла Ph. lucipetus были использованы 15 домашних птиц (утки, гуси и куриы). Первая группа (утки) заражались адолескариями перорально; вторая (гуси) - введением адолескарий в конъюнктиву с помощью глазной пипетки; третья - цыплята - введением церкарий в конъюнктиву глаз.
Птицы в течение опыта содержались в условиях, препятствующих её заражению указанной трематодой. Спустя 25 - 30 дней после заражения в полости конъюнктивы у исследованных птиц опытных групп обнаружено 47 экз. трематод. Они были идентифицированы как Ph. lucipetus.
Статистическая обработка данных проводилась с применением методов компьютерной программы Biostat 2007 и Microsoft Office Ecxel 2007.
Результаты и обсуждение
Популяции моллюсков M. kainarensis обитают в теплых родниках и образуемых ими ручьях и прудах на глубине до 15 - 20 см на каменных и заиленных грунтах с численностью 120 - 150 особей на кв. м.
Продолжительность жизни 5 - 8 лет. Питается бактериальными обрастаниями, микроводорослями (Старобогатов, Иззатуллаев, 1980; Красная книга Узбекистана, 2009).
При исследовании 2801 экз. M. kainarensis в 2014 - 2015 гг. у 308 экз. (10.8%) обнаружены церкарии трематоды Ph. lucipetus (табл. 1, рис. 1), которые локализовались в гепатопанкреасе.
Таблица 1
Естественная зараженность моллюсков Melanoides kainarensis
церкариями Philophthalmus lucipetus
|
Время года |
Исследовано, экз. |
Зараженность, (%) |
|
|
2014 |
Июнь |
415 |
32 (7.7) |
|
Июль |
581 |
64 (11.0) |
|
|
Август |
420 |
51 (12.1) |
|
|
2015 |
Январь |
64 |
7 (10.9) |
|
Июнь |
326 |
28 (8.6) |
|
|
Июль |
483 |
56 (11.6) |
|
|
Август |
512 |
70 (13.7) |
|
|
Итого: |
2801 |
308 (10.8) |
|
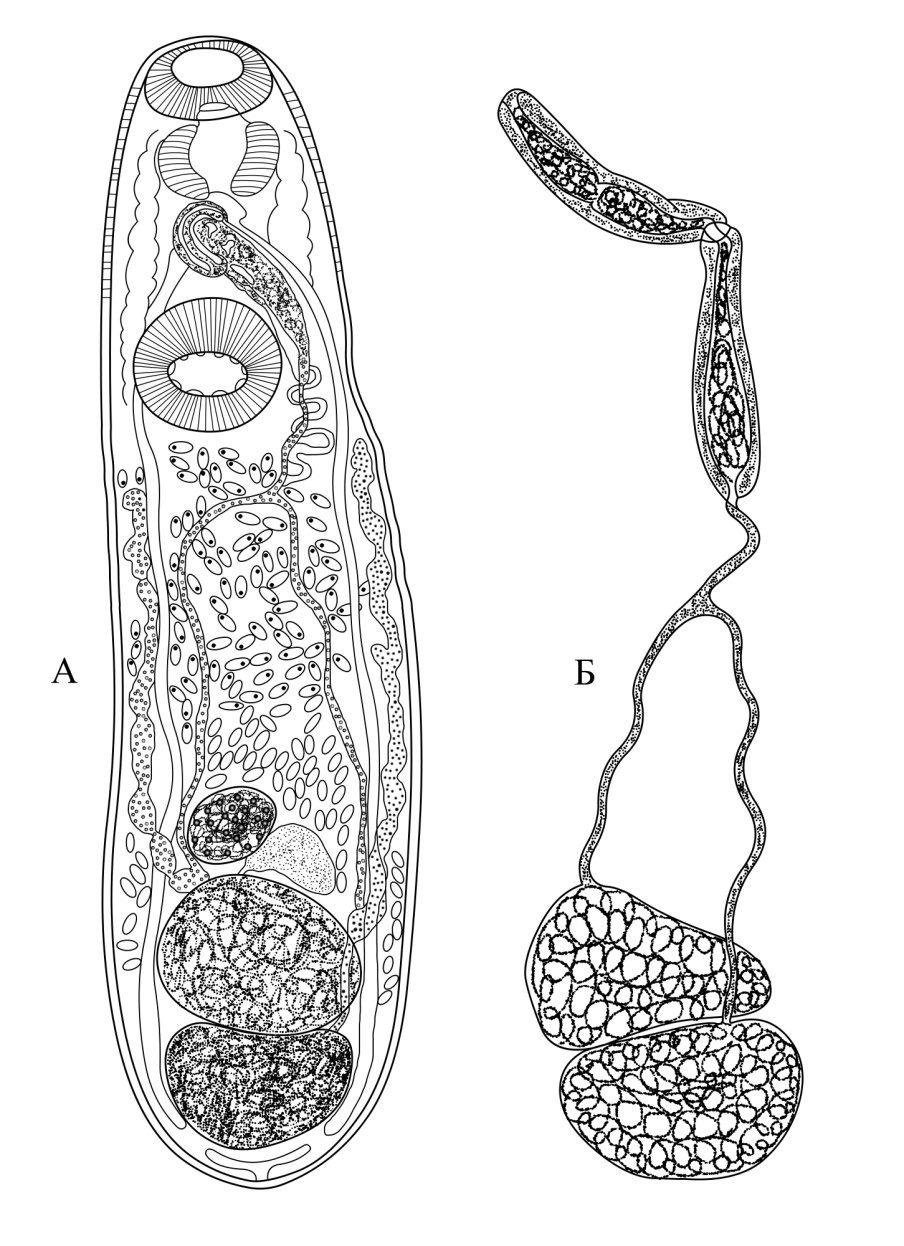
Рис. 1. Philophthalmus lucipetus (Rudolphi, 1819): А – Общий вид церкария;
Б - хвостовой конец церкария; В - процесс отторжения хвоста; Г - адолескария;
Е - эксцистированная метацеркария в печени моллюска. рп - ротовая присоска;
бп - брюшная присоска; мп - мочевой пузырь; хв - хвост; хп - хвостовая присоска.
Церкарии обладают довольно крупными размерами. Тело удлинено, овальное, 0.53 - 0.65 мм длины и 0.11 - 0.14 мм ширины. Максимальная ширина отмечена впереди брюшной присоски. Хвост 0.46 - 0.52 мм длины и 0.03 - 0.06 мм ширины. Хвостовой конец тупой, как бы обрубленный, где имеется присоскоподобное образование, снабженное железистыми клетками, протоки которых открываются на вершине хвоста. Субтерминальная ротовая присоска округлой формы, 0.04 - 0.06 мм длины и 0.04 - 0.05 мм ширины. Брюшная присоска 0.06 - 0.07 мм длины и 0.08 мм ширины. Ротовое отверстие субтерминальное. Префаринкс хорошо развит, глотка овальная, 0.03 - 0.04 мм длины и 0.01 - 0.02 мм ширины; пищевод достаточно длинный - 0.10 - 0.12 мм, бифурцирует впереди брюшной присоски; кишечные ветви длинные, которые заканчиваются слепо и доходят до заднего конца тела. Железистые клетки многочисленные, протоки которых открываются в передней части тела. Выделительная система построена по общему для филофтальмид типу, представлена большим числом циртоцитов, системой канальцев и мочевым пузырем. Экскреторная система выражается формулой 2[(3+3+3)+(2+2+2)]=30. Половые зачатки образованы скоплением клеточных масс, продольно расположенных в пространстве между бифуркацией пищевода и передней части мочевого пузыря.
Адолескарии, как правило, грушевидной формы, 0.48 - 0.52 мм длины и 0.20 - 0.24 мм ширины (табл. 2).
Таблица 2
Характеристика размеров церкарий и адолескарий
Philophthalmus lucipetus, мм
|
Показатели |
Промежуточный хозяин Melanoides kainarensis |
|
|
Церкарии: |
Limit |
M±m |
|
Тело: длина |
0.53-0.65 |
0.59±0.014 |
|
ширина |
0.11-0.14 |
0.12±0.003 |
|
Ротовая присоска: длина |
0.04-0.06 |
0.046±0.0021 |
|
ширина |
0.04-0.05 |
0.041±0.001 |
|
Брюшная присоска: длина |
0.06-0.07 |
0.06±0.001 |
|
ширина |
0.07-0.08 |
0.071±0.001 |
|
Глотка: длина |
0.03-0.04 |
0.03±0.001 |
|
ширина |
0.01-0.02 |
0.01±0.001 |
|
Пищевод - длина |
0.10-0.12 |
0.10±0.002 |
|
Головные железы |
20 пар |
|
|
Экскреторная система |
2[(3+3+3)+(2+2+2)]=30 |
|
|
Хвост: длина |
0.46-0.52 |
0.49±0.006 |
|
ширина |
0.03-0.06 |
0.042±0.003 |
|
Адолескарии: длина |
0.48-0.52 |
0.49±0.004 |
|
ширина |
0.20-0.24 |
0.22±0.004 |
Литературных сведений по вопросу развития Ph. lucipetus в дефинитивном хозяине немного (West, 1961; Alicata, 1962; Mukaratirwa et al., 2005; Pinto, 2009). Авторами изучалось развитие марит у птиц, экспериментально зараженных адолескариями, сформированных из церкарий, полученных от моллюсков (Melanoides tuberculatus, Tarebia granifera, Pleurocerca acuta).
Наши наблюдения за развитием Ph. lucipetus в окончательном хозяине, проводились с использованием личинок, выделенных из спонтанно зараженных моллюсков M. kainarensis в условиях Узбекистана.
Все подопытные птицы вскрывались через 25 - 30 дней после заражения. Такая схема эксперимента дала возможность определить влияние различных способов заражения птиц личинками (адолескариями и церкариями) этой трематоды.
Нами выяснилось (табл. 3), что в условиях эксперимента птицы всех групп, независимо от способа введения личинок, оказались зараженными, паразиты достигали половой зрелости и локализовались в инфраорбитальной области глаз. Интенсивность инвазии колебалась от 3 до 15 экз. Морфометрические данные (n-15) зрелых червей, представлены в таблице 4.
Таблица 3
Результаты экспериментального заражения домашних
птиц личинкми Philophthalmus lucipetus
|
Группы |
Число заданных личинок одной птице, экз. |
Число заразившихся птиц, экз. |
Интенсивность инвазии |
|
Группа первая: Gallus gallus dom. (5 ос.) |
25-30 |
5 |
9-15 |
|
Группа вторая: Anser anser dom. (5 ос.) |
25-30 |
5 |
5-13 |
|
Группа третья: Anas platyrhynchоs dom. (5 ос.) |
25-30 |
5 |
5-13 |
Тело мариты Ph. lucipetus удлиненное, оба конца равномерно округлые небольшого размера. Ротовая присоска терминальная, хорошо развита. Имеется префаринкс. Фаринкс расположен позади ротовой присоски. Пищевод небольшой, бифурцирует спереди брюшной присоски. Кишечные стволы тупо заканчиваются в задней части тела. Яичник округлой формы, лежит впереди семенников. Бурса цирруса расположена в пространстве между бифуркацией кишечника до задней части брюшной присоски. Половое отверстие находится вентрально от бифуркации кишечника и позади фаринкса. Желточники расположены аркой на каждой стороне тела и состоят из сплошных фолликулов. Матка мощно развита и ее петли занимают пространство от брюшной присоски до семенников. В матке многочисленные яйца со сформированными мирацидиями (табл. 4, рис. 2).
Таблица 4
Характеристика размеров (мм) марит Philophthalmus lucipetus от экспериментально зараженных птиц
|
Признаки |
Окончательные хозяева |
|
|
Gallus gallus dom., Anser anser dom., Anas platyrhynchоs dom. |
||
|
Limit |
M±m |
|
|
Тело |
1.90-2.46x0.68-1.46 |
2.206±0.055х1.087±0.075 |
|
Ротовая присоска |
0.24-0.32x0.28-0.38 |
0.278±0.007х0.317±0.009 |
|
Брюшная присоска |
0.36-0.48x0.36-0.48 |
0.421±0.009х0.421±0.009 |
|
Фаринкс |
0.23-0.36x0.20-0.32 |
0.306±0.009х0.266±0.009 |
|
Пищевод |
Короткий |
Короткий |
|
Передний семенник |
0.17-0.36x0.28-0.44 |
0.268±0.012х0.351±0.012 |
|
Задний семенник |
0.12-0.18x0.10-0.24 |
0.148±0.005х0.17±0.016 |
|
Яичник |
0.12-0.22x0.15-0.26 |
0.168±0.008х0.203±0.008 |
|
Яйцо |
0.08-0.09x0.03-0.04 |
0.083±0.001х0.033±0.001 |

Рис. 2. Philophthalmus lucipetus (Rudolphi, 1819):
А - Общий вид мариты; Б - мужеские половые органы.
Разными авторами описано около 36 видов трематод, относящихся к роду Philophthalmus (Kanev et al., 1993; Abdul - Salam et al., 2004; Radev et al., 2006). Структура рода, видовое разнообразие, особенности биологии подвергаются в настоящее время интенсивному изучению и ревизии (Pinto, 2009; Literák et al., 2013). Результаты исследований (Literák et al., 2013) показали идентичность Ph. gralli и Ph. lucipetus. Эти авторы перевели Ph. gralli в качестве синонима, Ph. lucipetus, что соответствует принципам приоритета. Мы, придерживаемся этой точки зрения.
Тем не менее, зрелые трематоды у птиц Узбекистана, пока не обнаружены. Выявление церкарий в моллюсках M. kainarensis, в локальном водоеме Узбекистана, вероятно, связано с заносом инвазии сезонной миграцией водно-болотных птиц из других регионов. Наличие биологических предпосылок способствовало формированию нового очага инвазии на этой территории. Популяции моллюсков M. kainarensis - стали выполнять роль нового промежуточного хозяина, рассматриваемой трематоды.
Следующий этап в жизни церкарий - эмиссия во внешнюю среду. Выход личинок Ph. lucipetus как правило, происходит в сумерках и ночью и в небольшом количестве в утренние часы. После непродолжительного плавания церкарии, как правило, прикрепляются хвостовым концом к субстратам водоема. В лабораторных условиях, как показали наблюдения, они прикрепляются к стенкам стакана или чашки Петри настолько крепко, что полностью нарушается поступательное движение личинок. При «иммобилизации» хвостового конца церкарии принимают вертикальное положение и совершают интенсивные маятникообразные и круговые движения, способствующие отторжению тела от хвостового ствола и инцистируются и превращается в адолескарий. При этом, на стенках сосуда (стакан, чашки Петри) концентрируется несколько групп адолескарий, состоящих из 5-10 экз., формируя при этом отдельные микроконгломераты.
Морфо-биологические особенности церкарий-представителей филофтальмид ранее были замечены рядом исследователей, которые сводятся к тому, что общей чертой организации личинок этих трематод является изменение хвоста, в связи с утратой им локомоторной функции, и превращением в орган прикрепления (Тихомиров, 1980; Галактионов, Добровольский, 1987, 1998; Атаев, 1991).
Дело в том, что в течение свободной жизни церкарий, ротовая и брюшная присоски вқполняют функции органов прикрепления, в которых располагаются секретирующие железистые клетки, протоки которых достигают поверхности присосок. Хвостовой ствол, при этом, выполняет локомоторную функцию (Гинецинская, 1968). Это характерная черта церкарий большинства трематод. В отличие от церкарий других трематод, на дистальном конце хвоста церкарий Philophthalmidae, имеется присоскоподобное образование, снабженное железистыми клетками, секретирующих клейкие массы, с помощью которых прикрепляются к субстрату (West, 1961; Pinto, 2009).
У Philophthalmus была отмечена и другая особенность, например, для заражения окончательного хозяина оказались инвазионными и церкарии Ph. rhionica (Галактионов, Добровольский, 1987). Это подтвердилось нашими исследованиями и в отношении Ph. lucipetus (настоящая работа).
Литература
1. Атаев Г.Л. Влияние температуры на развитие и биологию редий и церкарий Philophthalmus rhionica (Trematoda). // Паразитология, 1991. 25 (4): - С. 349 - 359.
2. Галактионов К.В., Добровольский А.А. Гермафродитное поколение трематод. Ленинград, Наука, 1987. - 193 с.
3. Галактионов К.В., Добровольский А.А. Происхождение и эволюция жизненных циклов трематод. Санкт - Петербург, Наука, 1998. - 403 с.
4. Гинецинская Т. А. Трематоды, их жизненные циклы, биология и эволюция. Ленинград, Наука, 1968. - 411с.
5. Жадин В.И. Моллюски пресных и солоноватых вод СССР. Определители по фауне СССР. АН СССР, Москва, Ленинград, 1952. - 374 с.
6. Красная книга республики Узбекистан. Животные. Ташкент, Chinor ENK, 2: 2009. - С. 40 - 41.
7. Лихарев И.М., Старобогатов Я.И. Материалы к фауне моллюсков Афганистана. Сб. «Моллюски и их роль в биоценозах и формировании фаун». // Труды Зоологического института АН СССР, Ленинград, Наука, 42: 1967. - С. 159 - 198.
8. Смогоржевская А.А. Гельминты водоплавающих и болотных птиц фауны Украины. Киев, Наукова думка, 1976. - 414 с.
9. Старобогатов Я.И., Иззатуллаев З.И. Моллюски семейства Melanoididae (Gastropoda, Pectinibanchia) Средней Азии и сопредельных территорий. // Зоологический журнал, Наука, LIX (1): 1980. - С. 23-31.
10. Тихомиров И.А. Жизненный цикл Philophthalmus rhionica sp. nov. (Trematoda: Philophthalmidae). Автореф. дис. ... канд. биол. наук. Ленинград, 1980. - 20 с.
11. Alicata J.E. Life cycle and development stages of Philophthalmus gralli in intermediate and final hosts. Journal of Parasitology., 48: 1962. - P. 47 - 54.
12. Abdul-Salam J., Sreelatha B.S., Ashkanani H. The eye fluke Philophthalmus hegeneri (Digenea: Philophthalmidae) in Kuwait Bay. Kuwait Journal of Science Eng., 31(1): 2004. - P. 119 - 133.
13. Greve J.H., Harrison G.J. Conjunctivitis caused by eye flukes in captive-reared ostriches. Journal of the American Veterinary Association, 177: 1980. - P. 909 - 910.
14. Kanev I., Nollen P.M., Vassilev I., Radev V., Dimitrov V. Redescription of Philophthalmus lucipetus (Rudolphi, 1819) (Trematoda: Philophthalmidae) with a discussion of its identity and characteristics. Annalen des Naturhistorisches Museum Wien 94/95B, 1993. - P. 11 - 34.
15. Literák I., Heneberg P., Sitko J., Wetzel E.J., Cardenas Callirgos J.M., Сapek M., Valle Basto D., Papousek I. Eye trematode infection in small passerines in Peru caused by Philophthalmus lucipetus, an agentwith a zoonotic potential spread by an invasive freshwater snail. Parasitology International, 62: 2013. - P. 390 - 396.
16. Mukaratirwa S., Hove T., Cindzi Z.M., Maononga D.B., Taruvinga M., Matenga E. First report of a field outbreak of the oriental eye-fluke, Philophthalmus gralli (Mathis & Leger 1910), in commercially reared ostriches (Struthio camelus) in Zimbabwe. Onderstepoort Journal of Veterinary Research, 72: 2005. - P. 203 - 206.
17. Pinto H.A. Infecҫão natural de Melanoides tuberculata (Mollusca: Thiaridae) por Centrocestus formosanus (Trematoda: Heterophyidae) e por Philophthalmus gralli (Trematoda: Philophthalmidae) no Brasil. Universidade Federal de Minas Gerais Instituto de Ciencias Biologicas Belo Horizonte, 2009. - P. 55 - 67.
18. Radev V., Kanev I., Fried B. Comments on eye-flukes (Philophthalmidae Looss, 1819) in the genera Philophthalmus and Natterophthalmus, with a re-designation of the type-species of Natterophthalmus. Zootaxa, 1223: 2006. - P. 19 - 22.
19. West A.F. Studies on the biology of Philophthalmus gralli Mathis and Leger, 1910 (Trematoda: Digenea). American Midland Naturalist, 66: 1961. - P. 363 - 383.
© 2016 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin. This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI)http://elibrary.ru/projects/citation/cit_index.asp) and the Agreement of 12.06.2014 (CA-BI.org/Human Sciences section: http://www.cabi.org/Uploads/CABI/publishing/fulltext-products/cabi-fulltext-material-from-journals-b...)