English version
УДК 619:576.895.773.4:639.111.16
DOI:
Поступила в редакцию 26.01.2017
Принята в печать 14.06.2017
Для цитирования:
Жданова О. Б., Окулова И. И., Ашихмин С. П., Миньков С. И. изучение изменений при гистологическом исследовании головного мозга у лося при паразитировании Cephenomyia ulrichii и профилактика заболевания // Российский паразитологический журнал. – М., 2017. – Т.40.- Вып.2.- С.
For citation:
Zhdanova O.B., Okulova I.I., Ashichmin S.P., Min’kov S.I. Brain disorders (cephenomiosis) in elks caused by Cephenomyia ulrichii and prevention of disease. Russian Journal of Parasitology, 2017, V. 40, Iss. 2, pp.
Изменения в головном мозге у лося при паразитировании CEPHENOMYIA ULRICHII и профилактика заболевания
Жданова О. Б.1,2, Окулова И. И.1,3, Ашихмин С. П. 1, Миньков С. И. 3
1 Кировская государственная медицинская академия Минздрава РФ, Россия, 610017, г. Киров, ул. К. Маркса, 112, e-mail: oliabio@yandex.ru
2 Всероссийский научно-исследовательский институт фундаментальной и прикладной паразитологии животных и растений им. К. И. Скрябина, 117218, Россия, Москва, ул. Б. Черемушкинская, 28
3 Всероссийский научно-исследовательский институт охотничьего хозяйства и звероводства им. проф. Б. М. Житкова, Россия, 610000, г. Киров, ул. Преображенская, 79, e-mail: oculova_i@@yandex.ru
РЕФЕРАТ
Цель исследования ‒ изучить изменения гистокартины и макроанатомические изменения при цефеномиозе у лося, оценить эффективность азида натрия против личинок оводов.
Материалы и методы. Проведены макроанатомические исследования носовой полости, синусов и евстахиевых труб. Далее проведены гистологические исследования головного мозга лося с личинками овода с целью изучения ряда аспектов патогенеза эстроза. Рассекали и снимали твердую мозговую оболочку. После извлечения мозга фиксацию проводили путем небольших разрезов мозга на пластины, которые помещали в фиксирующий раствор. Проводку и резку осуществляли общепринятыми методами, окраску срезов ‒ гематоксилином и эозином. Для просветления срезов использовали карбол-ксилол в соотношении 1 : 4‒1 : 10. При этом методе окраски ядра клеток лиловые или синие, цитоплазма ‒ розово-красного цвета, соединительная ткань ‒ светло-розового цвета. Изучено действие на личинок овода различных дезинфектантов: раствора азида натрия (0,1 %), хлорофоса (0,1 %) и формалина (1 %).
Результаты и обсуждение. При патанатомических исследованиях обнаружены ярко выраженные макроскопические признаки менингоэнцефалита (гиперемия, мелкие кровоизлияния, набухание мозга). Диагноз менингоэнцефалита подтвержден после гистологического исследования нескольких отделов головного мозга. При вскрытии обнаружили более 300 личинок цефеномий. При исследовании гистосрезов проводили дифференциальную дагностику с прионными энцефалитами. Отмечено наличие воспалительных инфильтратов вокруг сосудов, изменения в сосудистой стенке, диффузная пролиферативная реакция микро- и олигодендроглии. В патогенезе эстрозных энцефалитов, кроме непосредственного действия возбудителей инфекции на ткань мозга, определенное значение имеют и аллергические реакции, значение которых, по-видимому, особенно велико при подострых формах энцефалита, обусловленных паразитированием большого числа личинок. Наиболее эффективными против личинок оводов оказались растворы азида натрия и хлорофоса. В 0,1%-ном растворе азида натрия и хлорофоса личинки погибали в течение нескольких часов. Однако, в отличие от хлорофоса азид натрия не вызывал гибели микрофлоры почвы.
Ключевые слова: цефеномиоз, миаз, энцефалит, гистокартина, макроанатомические изменения, азид натрия, лось.
Введение
Миаз ‒ паразитарная болезнь млекопитающих и человека, вызванная личинками мух (оводов), которые питаются тканью хозяина. Нередко миазы сопровождаются патологией нервной системы. Однако микроскопическому изучению головного мозга уделяется недостаточно внимания, что связано со сложностью фиксации и исследования головного мозга. Ветеринарные врачи нередко ограничиваются макроанатомическим исследованием оболочек мозга, между тем гистологические исследования позволяют прояснить ряд особенностей патогенеза как, например, при проведении гистопатологических исследований головного мозга при эстрозе лося.
Из эндопаразитов для лося на первом месте по биологическому значению на Севере РФ стоят представители семейства Oesteridae, в меньшей степени ‒ гельминты (кишечные и диктиокаулы) [12]. В этом отношении копытные млекопитающие отличаются от хищников, у которых главными паразитами, сильно влияющими на численность, являются гельминты.
Личинки носоглоточного овода встречаются до 8‒10 июля включительно, а лоси, убитые весной, поражены ими, как правило, все. Носоглоточный овод из рода Cephenomyia паразитирует на всем пространстве ареала лося в Евразии. Лет взрослой стадии отмечают с конца июля по начало сентября. Самки овода живородящие и откладывают своих личинок налету в ноздри животного [8‒10, 14]. Выпадение взрослых личинок у животных происходит в июне‒июле. Состояние куколки длится около месяца. У одного животного часто встречаются личинки на разных стадиях развития, что можно объяснить неоднократными откладываниями оводом живых личинок (рис. 1).
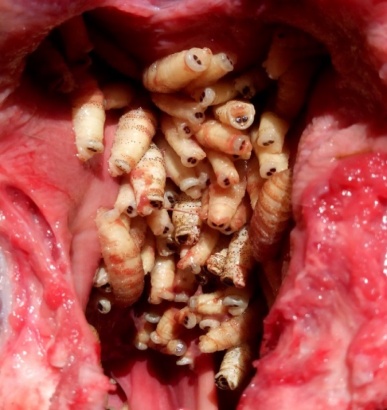
Рис. 1. Личинки Cephenomyia ulrichii в носоглотке лося
Периодическое изменение зараженности личинками популяций копытных может зависеть от метеорологических условий, времени выпадения личинок и лета взрослой стадии и места пребывания животного. В большей степени на развитие паразита влияют не климатические или физико-географические условия, а состояние систем гомеостаза лося в критический период выпадения личинок.
Локализуются личинки в глоточных пазухах, плотно присосавшись к ткани и выставив хвостовую часть с парой отверстий для дыхания. Отсюда они часто проникают в заднюю часть носовой полости, синусы и евстахиевы трубы. Личинки обладают чрезвычайно плотными наружными покровами, не поддающимися воздействию сильнодействующих веществ.
Целью наших исследований было изучение изменений гистокартины и макроанатомических изменений при цефеномиозе у лося, оценка эффективности азида натрия против личинок оводов
Материалы и методы
Проведены макроанатомические исследования носовой полости, синусов и евстахиевых труб. Голову животного фиксировали и осторожно, чтобы не повредить мозг, распиливали лобную кость с помощью анатомической пилы. Затем проводили надрезы лобной кости с каждой стороны от точек, находящихся на оси глазных ям, продлевая их каудально до наружных слуховых проходов. Продлевали эти разрезы каудально до большого затылочного отверстия также осторожно, чтобы исключить повреждение мозга. Делали сагиттальный разрез посредине лобной и затылочной костей до большого затылочного отверстия. Затем разделяли и удаляли распиленные левую и правую части черепной коробки. Рассекали и снимали твердую мозговую оболочку. После извлечения мозга фиксацию проводили путем небольших разрезов мозга на пластины или мозг целиком помещали в фиксирующий раствор. Затем кусочки головного мозга дополнительно фиксировали в течение суток в солевом растворе формалина, который готовили по следующей прописи: 8,5 г поваренной соли растворяли в 900 мл дистиллированной воды, затем добавляли 100 мл 4%-ного формалина. Вырезали кусочки зафиксированных тканей мозга в виде пластинок толщиной не более 0,5‒1 см из разных участков. Уплотнение материала проводили путем заливки в прозрачные среды (парафин, целлоидин). В последующем вырезали прямоугольные блоки, оставляя вокруг кусочка слой парафина шириной 1‒1,5 мм.
Достоинством метода заливки в парафин является относительная быстрота, возможность изготовления тонких (2‒3 мкм) серийных срезов, а недостатком ‒ некоторое уменьшение объема материала и воздействие высокой температуры.
После того, как были получены качественные блоки, готовили гистологические срезы. Для расправления срезы переносили в емкость с теплой (46‒48 °С) дистиллированной водой, температуру контролировали термометром и расправляли. Подготовленное ранее предметное стекло опускали концом в воду, подводили под срезы и подхватывали их препаровальной иглой за один из краев, затем плавно вынимали из воды стекло вместе со срезом. Срезы окрашивали гематоксилином и эозином.
Для просветления срезов использовали карбол-ксилол в соотношении 1 : 4‒1 : 10 (по объему). При этом методе окраски ядра клеток лиловые или синие, цитоплазма ‒ розово-красного цвета различного тона, соединительная ткань ‒ светло-розового цвета.
Результаты и обсуждение
У лося, зашедшего на территорию г. Кирова, наблюдали клиническую картину менингита. Животное было истощено, реакция на раздражители снижена, отмечали статическую и динамическую атаксию. При патанатомическом исследовании диагноз подтвержден. При вскрытии обнаружили более 300 личинок цефеномий.
Носоглоточный овод из рода Cephenomyia паразитирует на всем пространстве ареала лося в Евразии; он известен в Германии и Прибалтике, на европейской части РФ, Сибири и в Забайкалье. Как правило, в сроки, когда можно встретить личинок, обнаружена поголовная зараженность всех добытых зверей. В частности, представители семейства Oesteridae встречаются чаще, чем гельминты (кишечные и диктиокаулы) [5, 9, 10, 13‒16]. Самки овода вбрызгивают своих живых личинок на лету, приближаясь к голове и ноздрям животного [7, 8, 13‒16, 18]. Мельчайшие, очень подвижные, личинки, попав в жидкий субстрат назального секрета, быстро продвигаются в носовую и глоточную полости, где, видимо, и зимуют, задерживаясь в развитии до весенних месяцев, апреля‒мая [11, 16, 18]. Выпадение взрослых личинок у животных происходит в июне‒июле. Состояние куколки длится около месяца. Личинки оказывают токсическое воздействие на мозг и его оболочки. Заболевание сопровождается ринитом, фарингитом и пансинуситом. В тяжелых случаях присоединяется менингоэнцефалит. Мягкие оболочки, эпендима и сосудистые сплетения гиперемированы, отёчны, тускловаты, с множественными кровоизлияниями. В инфильтрате преобладают эозинофилы, лимфоциты, макрофаги и плазмоциты. Воспаление сопровождается выраженным отёком. При патанатомических исследованиях обнаружены ярко выраженные макроскопические признаки менингоэнцефалита (гиперемия, мелкие кровоизлияния, набухание мозга).
Диагноз менингоэнцефалита подтвержден после гистологического исследования нескольких отделов головного мозга. При исследовании гистосрезов проводили дифференциальную дагностику с прионными энцефалитами. Отмечено наличие воспалительных инфильтратов вокруг сосудов, изменения в сосудистой стенке, диффузная пролиферативная реакция микро- и олигодендроглии.
В патогенезе эстрозных энцефалитов, кроме непосредственного действия возбудителей инвазии на ткань мозга, определенное значение имеют и аллергические реакции, значение которых, по-видимому, особенно велико при подострых формах энцефалита, обусловленных паразитированием большого числа личинок.
Дистрофические изменения характеризуются расплавлением нейроглии, наличием пикноза, рексиса и частичного лизиса ядер нейронов (рис. 2). Также отмечены гипертрофия эндотелия кровеносных сосудов с явлениями кариопикноза и рексиса и наличие периваскулярных астроцитных и макрофагальных элементов типа негнойного энцефалита. Явления вакуолизации нейронов (перстневидные клетки) встречаются редко и они слабо выражены [9, 15].
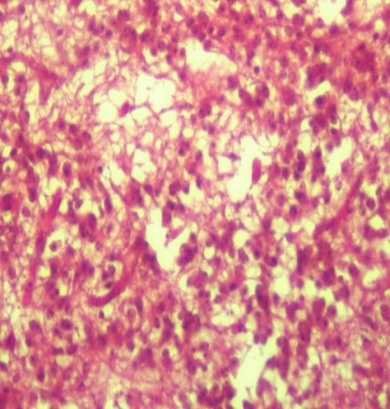
Рис. 2. Перинуклеарный отек и дистрофические изменения в нейронах (окраска гематоксилином и эозином, ув. × 100)
Изменения в глие свидетельствуют о снижении защиты мозга. Глия выполняет в ЦНС множество функций, направленных на поддержание стабильной работы нейронной сети. Одной из этих функций является организация внутренней иммунной системы мозга. При повреждениях, травмах, инфекции или нарушении гемато-энцефалического барьера активируются резидентные макрофаги нервной ткани ‒ микроглия. Этот процесс принято называть нейровоспалением. На клеточном уровне основным маркером нейровоспаления является увеличение числа микроглиоцитов. Активированная микроглия начинает секретировать провоспалительные факторы, а на определенной стадии микроглиальные клетки становятся макрофагами и начинают секретировать кроме цитокинов и оксид азота. Нейровоспаление, как любой воспалительный процесс в организме, на первом этапе, несомненно, имеет адаптивную природу, выполняя защитные функции. Однако чрезмерная активация воспалительного процесса продуктами жизнедеятельности личинок становится патологическим фактором. Пролиферация микроглии является более общим процессом, а изменения астроглии в ответ на хронический стресс являются более гибкой и специфической компонентой глиальной реакции, в том числе в патогенезе эстроза. Проявление реакции астроглии зависит от многих факторов, в частности, от силы стрессора и состояния гипоталамо-гипофизарно-адреналовой системы. [19]. Однако, наличие вокруг нейронов явлений отека и вакуолизации свидетельствует о преобладании альтеративных процессов.
Таким образом, энцефалит, несмотря на длительность течения, по гистокартине приближается к подострому и относится к токсико-аллергическим поражениям ЦНС [18, 19]. Нейровоспаления могут возникать в результате антигенных стрессов (паразитарных, вирусных или бактериальных инфекций). Активация иммунной системы организма приводит к увеличению уровня провоспалительных факторов в циркулирующей крови, проникновению их в мозг и, как следствие, к возникновению нейровоспалительных процессов. Кроме того, следует учитывать, что реакция головного мозга на флогоген отличается от иммунных процессов. Так, например, глюкокортикоиды в мозге не являются иммуносупрессорами, а, наоборот, оказывают провоспалительное действие. Показана высокая чувствительность гиппокампа к глюкокортикоидам, при этом хронический стресс вызывает селективное продолжительное возрастание уровня провоспалительных факторов в этой структуре [14, 15, 18, 19].
Учитывая вышесказанное, можно предположить, что длительное действие токсинов личинок приводит к нарастанию симптомов менингоэнцефалита, а при паразитировании большого их числа и к гибели животного.
Для сохранения популяции лося необходима разработка мероприятий по предупреждению рассеивания возбудителя во внешней среде. Следует учитывать, что хотя личинки на данной стадии развития не опасны для человека, однако, необходимо предотвращать их окукливание и сжигать или уничтожать с помощью химических веществ.
Нами предпринята попытка изучения действия различных дезинфектантов на личинок овода. При проведении сравнительных исследований по эффективности против личинок оводов и мух раствора азида натрия (0,1 %), хлорофоса (0,1 %) и формалина (1 %) установлено, что в 1%-ном растворе формалина личинки оставались живыми в течение 3‒4 сут. Выделенные от лося в Сибири личинки, помещенные в 4%-ный раствор формалина, сохраняли свою жизнеспособность в течение 3 сут [11]. Наиболее эффективными оказались растворы азида натрия и хлорофоса ‒ в 0,1%-ном растворе азида натрия и хлорофоса личинки погибали в течение нескольких часов. Однако, в отличие от формалина и хлорофоса азид натрия не вызывает гибели микрофлоры почвы и даже обладает стимуляцией размножения азотфиксирующих форм [1‒6].
Заключение
Всестороннее исследование головного мозга при эстрозах позволит уточнить ряд аспектов патогенеза данных заболеваний. Однако, исследование мозга связано с определенными трудностями. Ряд рекомендаций позволит охотникам и охотоведам проводить взятие материала, а ветеринарным работникам ‒ его исследование.
В первую очередь, материал для гистоисследований головного мозга должен быть свежим (при длительной транспортировке или в жаркую погоду целесообразно в контейнер положить лед). Для фиксации головного мозга путем использования несплошных поперечных разрезов на извлеченном головном мозге необходимо сделать поперечные разрезы в виде пластин толщиной 5‒8 мм. Более толстые пластины делать нельзя, так как формалин проникает и фиксирует ткани только на толщину не более 8 мм. Между пластинами ткани проложить гигроскопический материал (марлю, фильтровальную бумагу). Для фиксации головного мозга, разрезанного на продольные полосы, рекомендуется использовать 15%-ный раствор нейтрального формалина. Срок фиксации ‒ 3‒4 сут. Зафиксированный мозг помещают в ударопрочную емкость, при этом объем фиксирующего раствора должен быть в 10 раз больше объема мозга. В таком виде материал должен храниться не менее 2 недель, после чего его необходимо доставить в лабораторию. Патологический материал обязательно должен быть этикетирован и зафиксирован немедленно и непосредственно после взятия (но не позднее 12 ч). При соблюдении вышеуказанных условий возможны патогистологические исследования и уточнение патогенеза и симптоматики болезни.
Для радикального уничтожения насекомых необходимо вместе с обработкой контактными инсектицидами больных животных выявить и обработать места скопления куколок. Наиболее эффективен по нашим данным 0,1%-ный раствор азида натрия.
Литература
1. Ашихмин С. П., Жданова О. Б., Зайцева О. О., Мешандин А. Г. Современные аспекты применения азидных производных в медицине и биологии // Вестник новых медицинских технологий. ‒ 2007. ‒ Т. 14, № 3. ‒ С. 177‒179.
2. Ашихмин С. П., Домрачева Л. И., Жданова О. Б., Кондакова Л. В., Мутошвили Л. Р., Попов Л. Б. Экологические аспекты применения азида натрия в качестве консерванта и дезинфектанта почв урбанизированных территорий // Российский паразитологический журнал. ‒ 2010. ‒ № 2. ‒ С. 24‒29.
3. Ашихмин С. П., Жданова О. Б., Мартусевич А. К., Написанова Л. А., Клюкина Е. С. Некоторые кристаллоскопические свойства дезинфектантов и перспективы применения кристаллоскопической оценки в дезинфекции и дезинвазии // Российский паразитологический журнал. ‒ 2013. ‒ № 2. ‒ С. 88‒96.
4. Ашихмин С. П., Мартусевич А. К., Жданова О. Б. Азид натрия: некоторые физико-химические свойства и потенциальное место в дезинфектологии // Здоровье населения и среда обитания. ‒ 2012. ‒ № 4. ‒ С. 43‒45.
5. Ашихмин С. П., Жданова О. Б., Мартусевич А. К., Домрачева Л. И. Перспективы применения соединений азота для дезинвазии урбаноземов. Экологическое обоснование и практические вопросы (Монография) // Международный журнал прикладных и фундаментальных исследований. ‒ 2012. ‒ № 9. ‒ С. 117‒118.
6. Гайфутдинова А. Р., Домрачева Л. И., Дроздова Н. В., Старкова Д. Л., Жданова О. Б., Ашихмин С.П. Влияние возрастающих концентраций азида натрия на аборигенную микрофлору полевых почв // Матер. X Всерос. науч.-практ. конф. с междунар. уч. «Биодиагностика состояния природных и природно-техногенных систем». ‒ 2012. ‒ С. 138‒141.
7. Грунин К. Я. Носоглоточные овода (Фауна СССР. Насекомые двукрылые, Т. 17, Вып. 1) (Oestridae). ‒ М.‒Л., 1957 (Т. 19, Вып. 3).
8. Гиляров М. С. Жизнь животных. Членистоногие: трилобиты, хелицеровые, трахейнодышащие. Онихофоры / под ред. М. С. Гилярова, Ф. Н. Правдина. ‒ М.: Просвещение, 1984. ‒ Т. 3. ‒ 463 с.
9. Жданова О. Б., Ашихмин С. П., Клюкина Е. С., Парамонова А. Н., Мутошвили Л. Р. Новые методологические решения в патоморфологии гельминтозов // Российский паразитологический журнал. ‒ 2010. ‒ № 4. ‒ С. 74‒82.
10. Жданова О. Б. Паразитозы плотоядных (патогенез, иммуноморфология и диагностика): автореф. дис. ... д-ра биол. наук. ‒ М., 2007. ‒ 42 с.
11. Капланов Л. Г. Тигр, изюбрь, лось. ‒ М., 1947. ‒ 67 с.
12. Мутошвили Л. Р., Клюкина Е. С., Ашихмин С. П., Жданова О. Б., Домрачева Л. И., Масленникова О. В., Попов Л. Б., Кондакова Л. В., Распутин П. Г., Мартусевич А. К., Пестрикова О. А. Влияние некоторых дезинфектантов на инвазионные биоагенты и оценка их безопасности для окружающей среды // Матер. VII Всерос. науч.-практ. конф. «Проблемы региональной экологии в условиях устойчивого развития». ‒ 2009. ‒ С. 66‒69.
13. Окулова И. И., Жданова О. Б. Патологоморфологические изменения в органах дыхания и некоторые аспекты патогенеза при диктиокаулезе лося // Российский паразитологический журнал. ‒ 2015. ‒ № 3. ‒ С. 53‒56.
14. Окулова И. И., Миньков С. И., Кокорина А. Е., Жданова О. Б., Ашихмин С. П. К вопросу о паразитировании Cephenomyia ulrichii у лосей // Международный журнал прикладных и фундаментальных исследований. ‒ 2016. ‒ № 7‒3. ‒ С. 515.
15. Окулова И. И., Жданова О. Б. Прионные инфекции, некоторые аспекты их диагностики и профилактики // Вятский медицинский вестник. ‒ 2016. ‒ № 1 (49). ‒ С. 21‒24.
16. Окулова И. И., Жданова О. Б., Ашихмин С. П., Кокорина А. Е., Часовских О. В., Ерилов Д. В., Горохов В. A. Особенности цефеномийоза, вызванного Cephenomyia ulrichii в Кировской области и некоторые вопросы его профилактики // Международный журнал прикладных и фундаментальных исследований. ‒ 2016. ‒ № 7‒6. ‒ С. 1003‒1006.
17. Попов Л. Б., Домрачева Л. И., Жданова О. Б. Биологическая оценка риска от применения азида натрия при дезинвазии урбанозёмов // Матер. VIII Всерос. науч.-практ. конф. с междунар. уч. «Современные проблемы биомониторинга и биоиндикации». ‒ 2010. ‒ С. 114‒117.
18. Тишкина А. О. Реакция микроглии и астроцитов мозга грызунов на хронический стресс различной модальности: автореф. дис. ... канд. биол. наук. ‒ 2013. ‒ 27 с.
19. Pape T. Phylogeny of Oestridae (insect Diptera). Systematic Entomology, 2001, vol. 26, no 2, pp. 133‒171.
© 2017 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin. This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI) http://elibrary.ru/projects/citation/cit_index.asp) and the Agreement of 12.06.2014 (CA-BI.org/Human Sciences section: http://www.cabi.org/Uploads/CABI/publishing/fulltext-products/cabi-fulltext-material-from-journals-b...)