Скачать статью в PDF формате
English version
English versionФАУНА, МОРФОЛОГИЯ И СИСТЕМАТИКА ПАРАЗИТОВ
УДК 576.895.1: 598.2
DOI:
Поступила в редакцию 02.06.2017
Принята в печать 19.09.2017
Для цитирования:
Куклин В.В. Бургомистр (Larus hyperboreus Gunnerus, 1767) Баренцева моря: обзор гельминтофауны и возможность использования в качестве индикатора паразитологической ситуации // Российский паразитологический журнал. – М., 2017. – Т.41, Вып.3. – С.
For citation:
Kuklin V.V. Glaucous gull (Larus hyperboreus Gunnerus, 1767) in the Barents Sea: A review of helminthfauna and the possibility of using as an indicator of parasitological situation. Russian Journal of Parasitology, 2017, V. 41, Iss.3, pp.
Бургомистр (Larus hyperboreus Gunnerus, 1767) Баренцева моря: обзор гельминтофауны и возможность использования в качестве индикатора паразитологической ситуации
Куклин В. В.
Мурманский морской биологический институт КНЦ РАН, 183010 Мурманск, ул. Владимирская, д. 17, e-mail: VV_Kuklin@mail.ru
Реферат
Цель исследования – Анализ гельминтофауны бургомистров (Larus hyperboreus Gunnerus, 1767) Баренцева моря и оценка возможности их использования в качестве индикаторов паразитологической ситуации в регионе.
Материалы и методы. Материалом служили данные литературы по гельминтофауные бургомистров в различных районах Баренцева моря – северной части Кольского залива, Южном и Северном островах Новой Земли, архипелагах Земля Франца-Иосифа и Шпицберген, острове Медвежий, а также в юго-восточной части Баренцева моря.
Помимо анализа таксономического состава гельминтофауны, определены количественные показатели заражения птиц – экстенсивность инвазии (ЭИ) и индекс обилия (ИО). Проведена статистическая обработке результатов с использованием F-распределения Фишера и оценка сходства состава гельминтофауны бургомистров и ряда других видов птиц Баренцева моря с использованием коэффициента Серенсена.
Также проведено сравнение зараженности птиц на западном (архипелаг Шпицберген, о. Медвежий, Кольский залив) и восточном (Земля Франца-Иосифа, Новая Земля, о. Вайгач) участках водоема.
Результаты и обсуждение. Установлено, что для гельминтофауны бургомистров характерно высокое видовое разнообразие (34 вида – 8 видов трематод, 16 видов цестод, 8 видов нематод, 2 вида скребней) и низкие значения количественных показателей инвазии (ЭИ и ИО). По видовому разнообразию гельминтофауны из всех баренцевоморских птиц бургомистры уступают только серебристым чайкам. Это обусловлено прежде всего широким распространением и высокой трофической пластичностью бургомистров. Невысокие значения параметров инвазии, видимо, объясняются, во-первых, неблагоприятными условиями среды и низким разнообразием потенциальных промежуточных хозяев гельминтов в арктических биоценозах, во-вторых, использованием бургомистрами тех вариантов кормовой стратегии, при которых шансы на заражение гельминтами минимальны – хищничество, сбор пищевых отходов и наземных кормов.
В западной части Баренцева моря фауна гельминтов бургомистров богаче, чем в восточной, ввиду более благоприятных условий для реализации жизненных циклов многих паразитов. Проведенный анализ показал, что разрешающая способность использования бургомистров в качестве вида-индикатора “паразитологического фона” на Баренцевом море может быть достаточно высока, и на настоящий момент именно этот вид птиц представляется наиболее перспективным объектом для указанной цели.
Ключевые слова: гельминты; бургомистр; жизненный цикл; вид-индикатор; паразитологическая ситуация; Баренцево море.
Введение
В последние годы в связи с активным развитием прибрежных аквахозяйств (в том числе и на побережье Баренцева моря) важное значение имеет оценка паразитологической обстановки в районах размещения объектов марикультуры. Без предварительных паразитологических исследований, в частности, в работе рыбных ферм могут возникнуть серьезные проблемы [43, 49]. При наличии очагов паразитарной инвазии вблизи марихозяйств скученность и ослабленная резистентность рыб при искусственном разведении способствуют быстрому распространению заболеваний и тяжелой форме их протекания, что приводит к снижению товарного качества продукции, массовой гибели молоди и экономическим убыткам. При этом ключевую роль в распространении многих паразитов в силу большой численности и высокой подвижности играют морские птицы.
Оценка паразитологической ситуации в регионе подразумевает выяснение видового состава встречающихся здесь паразитов, определение путей их циркуляции, вычисление количественных показателей заражения и локализацию очагов инвазии [3]. Для успешного выполнения такой задачи важное значение имеет обоснованный выбор объектов исследований. Детальную оценку можно получить только в результате комплексного обследования максимально возможного числа промежуточных и окончательных хозяев паразитов. Это обусловлено тем, что многие паразиты имеют сложные жизненные циклы, в реализации которых в качестве хозяев участвуют животные из самых разных таксономических групп, а для паразитов с прямым циклом развития нередко характерна широкая гостальная специфичность. Соответственно, и при выборе для изучения потенциальных окончательных хозяев необходимо выполнение ряда важных требований. В оптимальном варианте эти животные должны отличаться друг от друга по типу питания и составу рациона, особенностям поведения в различные сезоны (кочевки, миграции, периоды размножения и ухода за потомством) и характеру распространения в обследуемом районе.
На практике проведение таких работ часто затруднено, а порой и невозможно из-за организационных и методических сложностей. Поэтому с целью получения общего представления о состоянии и функционировании паразитарных систем в ряде случаев удобна для использования информация, полученная с помощью индикаторных методов оценки.
Определению и детальному изучению видов-индикаторов уделялось особое внимание при проведении многих экосистемных исследований [27, 34, 36, 40]. Вместе с тем, опыт использования в качестве биоиндикаторов различных групп микроорганизмов, растений и животных показал, что выбрать универсальные индикаторы и универсальные критерии их отбора практически невозможно. В каждом конкретном случае выбор определяется тем, какие параметры экосистемы и какие аспекты ее функционирования представляют интерес для исследователей (оценка биологического разнообразия, определение экологических связей в биоценозе, выявление изменений в состоянии окружающей среды).
Такой подход выглядит вполне оправданным и при изучении гельминтофауны морских птиц, в частности, в Баренцевоморском регионе. Для оценки фоновой паразитологической ситуации при выборе вида-индикатора среди критериев, необходимых для его определения, следует выделить два, имеющих, как представляется, первостепенное значение. Во-первых – широкий спектр питания, благодаря чему шансы на попадание в окончательного хозяина имеет максимально возможное число видов паразитов. Во-вторых – повсеместное распространение на территории района, в котором проводятся исследования. В этом случае минимизируются риски “случайного пропуска” локальных очагов инвазии.
Несмотря на обилие и разнообразие баренцевоморской орнитофауны, выбор вида-индикатора для оценки паразитологической ситуации в регионе довольно затруднителен. Это связано с тем, что к повсеместно встречающимся на побережьях Баренцева моря птицам относится лишь 6 видов – моевка (Rissa tridactyla Linnaeus, 1758), полярная крачка (Sterna paradisea Pontoppidan, 1763), атлантический чистик (Cepphus grylle Linnaeus, 1758), толстоклювая кайра (Uria lomvia Linnaeus, 1758), обыкновенная гага (Somateria mollissima Linnaeus, 1758) и морской песочник (Calidris maritima Brünnich, 1764) [1]. При этом для каждого из видов характерна та или иная степень пищевой специализации, и некоторые группы кормов в их рационе частично или полностью отсутствуют (например, многие виды моллюсков и литоральных ракообразных – у моевок, крачек, чистиков и кайр, рыбные корма – у гаг и морских песочников) [1, 15]. Распространение же ярко выраженных полифагов, в первую очередь морских (Larus marinus Linnaeus, 1758) и серебристых (Larus argentatus Pontoppidan, 1763) чаек, ограничено южной частью Баренцева моря [30, 32].
С учетом этих обстоятельств для анализа возможного использования в качестве вида-индикатора был выбран другой представитель крупных чаек р. Larus – бургомистр (Larus hyperboreus Gunnerus, 1767). В сезон размножения бургомистры встречаются в основном в районах высокоширотных архипелагов (Шпицберген, Земля Франца-Иосифа, Новая Земля) и в юго-восточной части Баренцева моря (Печорском море) [31], а на побережье Кольского полуострова гнездятся крайне редко [12]. Однако значительная часть баренцевоморской популяции бургомистров проводит зимовку в губах и бухтах Мурманского прибрежья, образуя, в частности, довольно крупные скопления в Кольском заливе [13, 14]. Поэтому в зимнее время бургомистры могут выполнять роль окончательных хозяев для многих гельминтов, циркулирующих в экосистемах Мурманского побережья. К тому же эти птицы – типичные эврифаги, использующие самые разнообразные корма (в зависимости от их наличия и доступности) и различные способы добывания пищи [1, 31].
Фауна паразитических червей бургомистров в различных районах баренцевоморской части ареала изучена достаточно детально [17, 19, 21, 22, 25, 38, 48]. Благодаря этому представляется возможным рассмотреть ряд важных аспектов экологии и распространения гельминтов чаек и определить перспективность дальнейшего специализированного исследования этих птиц для характеристики общего “гельминтологического фона” в указанном районе.
Цель работы – исследование гельминтофауны бургомистров Баренцева моря и оценка возможности их использования в качестве индикатора паразитологической ситуации в регионе.
Материал и методы
Материалом служили данные литературы по результатам исследования гельминтофауны бургомистров в различных районах Баренцева моря – северной части Кольского залива [19], Южном [25] и Северном [17] островах Новой Земли, архипелагах Земля Франца-Иосифа [38] и Шпицберген [22], острове Медвежий [48], а также в юго-восточной части Баренцева моря (прибрежье острова Вайгач) [21] (рисунок).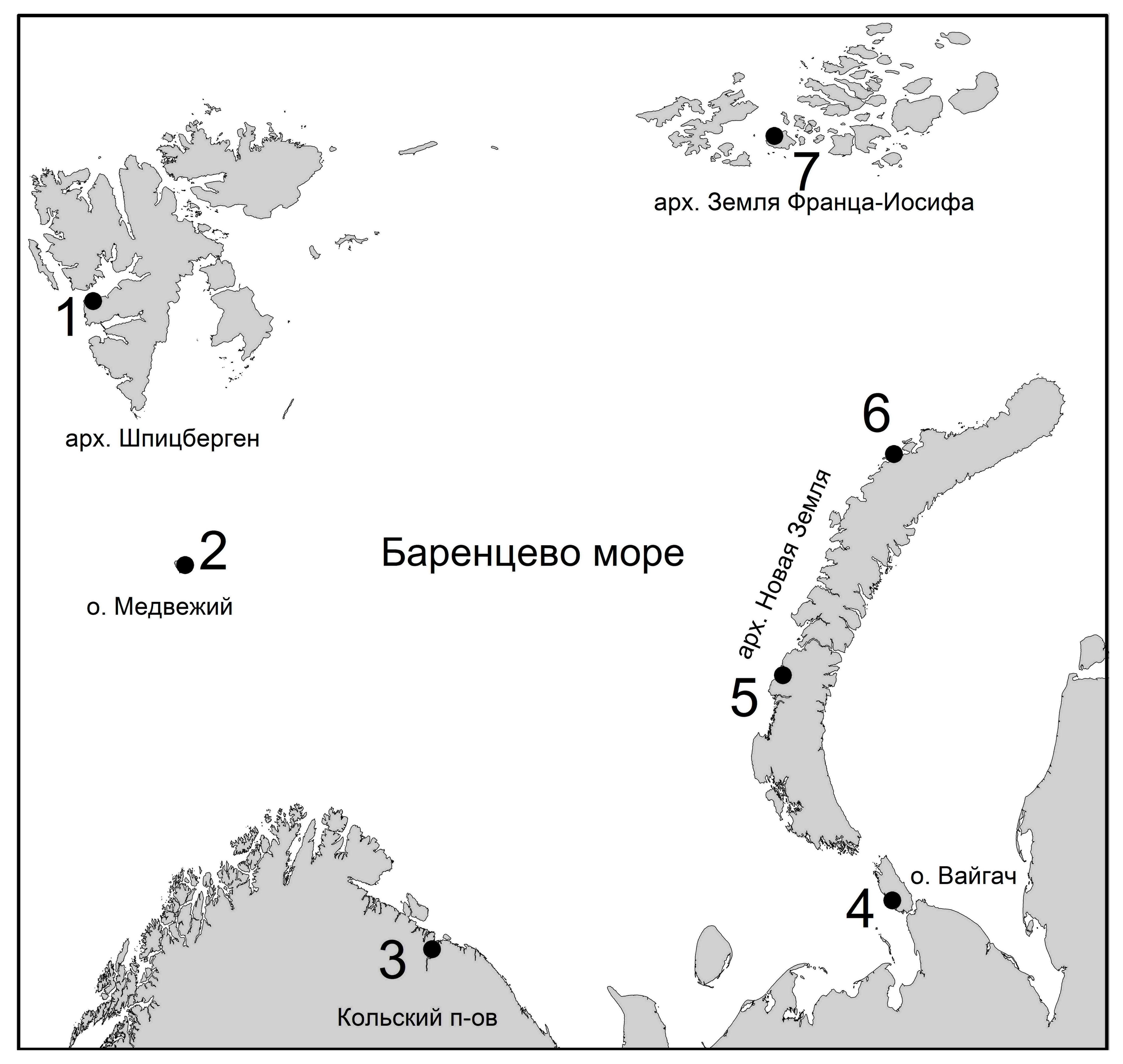
Рисунок. Районы, в которых проводилось гельминтологическое обследование бургомистров: 1 – залив Грен фьорд, архипелаг Шпицберген, 2 – о. Медвежий, 3 – Кольский залив, 4 – о. Вайгач, 5 – губа Безымянная, Южный остров Новой Земли, 6 – губа Архангельская, Северный остров Новой Земли, 7 – о. Гукера, архипелаг Земля Франца-Иосифа.
Помимо анализа таксономического состава гельминтофауны, определены количественные показатели заражения птиц – экстенсивность инвазии, ЭИ (отношение числа птиц, зараженных паразитом данного вида, к общему числу птиц в выборке) и индекс обилия, ИО (отношение общего числа особей данного вида паразита во всех обследованных птицах к общему числу птиц в выборке). При статистической обработке результатов использованы методы расчета и сравнения доверительных интервалов экстенсивности инвазии при 5% уровне значимости, основанные на использовании F-распределения Фишера [8].
Кроме того, произведена оценка сходства состава гельминтофауны бургомистров и ряда других видов птиц Баренцева моря с использованием коэффициента Серенсена [26].
Наряду с общим анализом гельминтофауны баренцевоморских бургомистров, проведено сравнение зараженности птиц на западном (архипелаг Шпицберген, о. Медвежий, Кольский залив) и восточном (Земля Франца-Иосифа, Новая Земля, о. Вайгач) участках водоема.
Результаты
Согласно имеющимся к настоящему времени данным, гельминтофауна бургомистров Баренцева моря включает 34 вида паразитических червей (8 – трематод, 16 – цестод, 8 – нематод, 2 – скребней) (табл. 1). У 8 видов ЭИ превышает 10%; наивысшие значения этого показателя характерны для цестод Microsomacanthus ductilus и Tetrabothrius erostris, а также трематод Cryptocotyle lingua и нематод Paracuaria adunca. Величины ИО, как правило, незначительны, и только у C. lingua и M. ductilus они превышают 10 экз. Находки 9 видов гельминтов (3 – трематод, 4 – цестод, 2 – нематод) оказались единичными.
Таблица 1
Гельминтофауна и количественные показатели зараженности бургомистров Баренцева моря
|
Виды гельминтов |
Баренцево море (п=110) |
Западная часть (Шпицберген, о. Медвежий, побережье Мурмана) (по: Sagerup et al., 2000; Куклин и др., 2005; Куклин, 2015) (п=74) |
Восточная часть (Печорское море, Новая Земля, Земля Франца-Иосифа) (по: Марков, 1941; Galaktionov, 1996; Куклин, 2001; Куклин, Куклина, 2013) (п=36) |
|||
|
ЭИ, % |
ИО, экз. |
ЭИ, % |
ИО, экз. |
ЭИ, % |
ИО, экз. |
|
|
Trematoda |
|
|
|
|
|
|
|
Сем. Heterophyidae |
|
|
|
|
|
|
|
Cryptocotyle lingua |
30.00 (39.5–21.6) |
62.15 |
44.59 (56.6–33.0) |
92.39 |
– |
– |
|
Сем. Gymnophallidae |
|
|
|
|
|
|
|
Gymnophallus deliciosus
|
10.00 (17.2–5.1) |
0.51 |
5.41 (13.3–1.5) |
0.30 |
19.44 (36.0–8.2) |
0.94 |
|
Gymnophallus sp (somateriae?) |
1.82 (6.4–0.2) |
0.05 |
2.70 (9.4–0.3) |
0.07 |
– |
– |
|
Сем. Echinostomatidae |
|
|
|
|
|
|
|
Himasthla larina |
7.27 (13.8–3.2) |
4.24 |
10.81 (20.2–4.8) |
6.30 |
– |
– |
|
Сем. Microphallidae |
|
|
|
|
|
|
|
Microphallus sp (pygmaeus?) |
1.82 (6.4–0.2) |
2.15 |
2.70 (9.4–0.3) |
3.20 |
– |
– |
|
Maritrema arenaria |
0.91 (5.0–0.1) |
0.04 |
1.35 (7.3–0.1) |
0.05 |
– |
– |
|
Сем. Diplostomidae |
|
|
|
|
|
|
|
Diplostomum spathaceum
|
0.91 (5.0–0.1) |
0.02 |
– |
– |
2.78 (14.5–0.1) |
0.06 |
|
Diplostomum sp |
0.91 (5.0–0.1) |
0.01 |
– |
– |
2.78 (14.5–0.1) |
0.03 |
|
Cestoda |
|
|
|
|
|
|
|
Сем. Diphyllobotriidae |
|
|
|
|
|
|
|
Diphyllobothrium ditremum |
0.91 (5.0–0.1) |
0.02 |
– |
– |
2.78 (14.5–0.1) |
0.06 |
|
Сем. Hymenolepididae |
|
|
|
|
|
|
|
Microsomacanthus ductilus
|
40.00 (49.8–30.8) |
19.98 |
50.00 (61.9–38.1) |
25.08 |
19.44 (36.0–8.2) |
9. 50 |
|
Microsomacanthus microsoma
|
4.54 (10.3–1.5) |
1.67 |
2.70 (9.4–0.3) |
0.18 |
8.33 (22.5–1.8) |
4.75 |
|
Microsomacanthus diorchis
|
1.82 (6.4–0.2) |
2.32 |
2.70 (9.4–0.3) |
3.45 |
– |
– |
|
Сем. Dilepididaе |
|
|
|
|
|
|
|
Alcataenia larina
|
0.91 (5.0–0.1) |
0.03 |
1.35 (7.3–0.1) |
0.04 |
– |
– |
|
Alcataenia dominicana
|
15.45 (23.6–9.3) |
1.95 |
17.57 (28.2–9.7) |
1.05 |
11.11 (26.1–3.1) |
3.78 |
|
Anomotaenia micracantha micracantha
|
18.18 (26.7–11.5) |
3.05 |
14.86 (25.0–7.7) |
3.97 |
25.00 (42.2–12.1) |
1.14 |
|
Paricterotaenia porosa
|
9.09 (16.1–4.4) |
0.45 |
8.11 (16.8–3.0) |
0.12 |
11.11 (26.1–3.1) |
1.11 |
|
Arctotaenia tetrabothrioides
|
3.64 (9.0–1.0) |
1.61 |
5.41 (13.3–1.5) |
2.39 |
– |
– |
|
Сем. Tetrabothriidae |
|
|
|
|
|
|
|
Tetrabothrius erostris
|
34.54 (44.2–25.7) |
2.42 |
35.13 (47.1–24.4) |
2.74 |
33.33 (51.0–18.6) |
1.61 |
|
Tetrabothrius cylindraceus
|
5.45 (11.5–2.0) |
0.64 |
– |
– |
16.67 (32.8–6.4) |
1.94 |
|
Tetrabothrius morschtini
|
3.64 (9.0–1.0) |
0.05 |
– |
– |
11.11 (26.1–3.1) |
0.17 |
|
Сем. Aploparaksidae |
|
|
|
|
|
|
|
Wardium fryei
|
0.91 (5.0–0.1) |
0.20 |
1.35 (7.3–0.1) |
0.30 |
– |
– |
|
Wardium cirrosa
|
0.91 (5.0–0.1) |
0.81 |
1.35 (7.3–0.1) |
1.20 |
– |
– |
|
Wardium manubriatum*
|
3.64 (9.0–1.0) |
0.78 |
– |
– |
11.11 (26.1–3.1) |
2.39 |
|
Aploparaksis brachiphallos**
|
1.82 (6.4–0.2) |
0.07 |
2.70 (9.4–0.3) |
0.11 |
– |
– |
|
Nematoda |
|
|
|
|
|
|
|
Сем. Acuariidae |
|
|
|
|
|
|
|
Paracuaria adunca
|
27.27 (36.6–19.2) |
1.06 |
37.84 (49.9–26.8) |
1.42 |
5.56 (18.7–0.7) |
0.33 |
|
Сем. Anisakidae |
|
|
|
|
|
|
|
Anisakis sp (simplex?) (L3-L4) |
7.27 (13.8–3.2) |
1.41 |
10.81 (20.2–4.8) |
2.09 |
– |
– |
|
Hysterothylacium aduncum
|
6.36 (12.7–2.6) |
0.12 |
9.46 (18.5–3.9) |
0.18 |
– |
– |
|
Contracaecum osculatum l
|
3.64 (9.0–1.0) |
0.58 |
5.41 (13.3–1.5) |
0.86 |
– |
– |
|
Сем. Streptocaridae |
|
|
|
|
|
|
|
Streptocara crassicauda
|
1.82 (6.4–0.2) |
0.05 |
2.70 (9.4–0.3) |
0.07 |
– |
– |
|
Stegophorus stellaepolaris
|
17.27 (25.7–10.7) |
0.42 |
25.68 (37.2–16.2) |
0.62 |
– |
– |
|
Seuratia sp (shipleyi?) |
0.91 (5.0-0.1) |
0.02 |
– |
– |
2.78 (14.5–0.1) |
0.06 |
|
Сем. Capillariidae |
|
|
|
|
|
|
|
Capillaria sp |
0.91 (5.0–0.1) |
0.01 |
– |
– |
2.78 (14.5–0.1) |
0.03 |
|
Acanthocephala |
|
|
|
|
|
|
|
Сем. Polymorphidae |
|
|
|
|
|
|
|
Corynosoma strumosum
|
18.18 (26.7–11.5) |
0.35 |
25.68 (37.2–16.2) |
0.51 |
2.78 (14.5–0.1) |
0.03 |
|
Polymorphus phippsi
|
3.64 (9.0–1.0) |
0.17 |
2.70 (9.4–0.3) |
0.07 |
5.56 (18.7–0.7) |
0.39 |
ПРИМЕЧАНИЯ:
В скобках приведены значения верхней и нижней границ точного 95%-го доверительного интервала;
* – в первоисточнике [25] указанный вид упоминается, как “Wardium fusa”. Позднее это название было сведено к синонимике вида W. manubriatum [2];
** – в первоисточнике [48] указанный вид упоминается, как “Aploparaksis larina”. Позднее это название было сведено к синонимике вида A. brachiphallos [2].
Из 34 обнаруженных видов гельминтов у 23 жизненные циклы реализуются в морских экосистемах, у 5 – в пресноводных. У 2 видов циркуляция также происходит в пресных водоемах, но в качестве паратенических хозяев могут использоваться проходные рыбы. Информация о жизненных циклах и промежуточных хозяевах еще 4 видов паразитов, найденных в бургомистрах, в настоящий момент отсутствует.
Поскольку в западной части Баренцева моря условия среды смягчены благодаря влиянию теплых течений – Шпицбергенского и Мурманского (северо-восточных ветвей атлантического течения Гольфстрим) – возможности для успешной реализации жизненных циклов многих гельминтов в западных и восточных районах моря могут сильно различаться. При сравнительном анализе в западной части Баренцева моря у бургомистров зарегистрировано 26 видов паразитических червей, в восточной – 18 видов. При этом исключительно в западных районах у птиц найдено 16 видов гельминтов, а только в восточных – 8. Соответственно, 10 видов паразитов обнаружены и на западном, и на восточном участках моря. Из них статистически достоверные отличия в ЭИ (α < 0.05) отмечены для цестод M. ductilus, нематод P. adunca и скребней Corynosoma strumosum – значения этого параметра для указанных паразитов заметно выше у птиц в западном районе. Обращает на себя внимание полное отсутствие у птиц в восточной части Баренцева моря двух видов гельминтов, общая ЭИ которыми на Баренцевом море превышает 15% – трематод C. lingua и нематод Stegophorus stellaepolaris. Кроме того, несколько видов паразитов имели довольно высокие значения ЭИ (≥ 10%) в одном из районов (трематоды Himasthla larina и нематоды Anisakis sp (simplex?) – в западном, цестоды Tetrabothrius cylindraceus, T. morschtini и Wardium manubriatum – в восточном), но при этом полностью отсутствовали в другом.
Обсуждение
Результаты ранее проведенных исследований дают все основания полагать, что паразитарные системы Баренцева моря с участием гельминтов, использующих морских птиц в качестве окончательных хозяев – это высоко интегрированные структуры, успешно функционирующие благодаря широкой специфичности многих видов паразитов и «перекрыванию» кормовых спектров различных птиц [4, 20]. В этом аспекте роль бургомистров представляется особенно интересной и важной.
По видовому разнообразию гельминтофауны из всех баренцевоморских птиц бургомистры уступают только серебристым чайкам [21]. Очевидно, что в первую очередь это связано с высокой трофической пластичностью птиц. Пищевой спектр бургомистров очень широк, и в нем значительную долю занимают промежуточные и паратенические хозяева многих гельминтов – прежде всего рыбы и разнообразные беспозвоночные (ракообразные, моллюски, аннелиды, иглокожие), которых чайки добывают сами или отнимают у других птиц [5, 6, 11, 37, 47]. Поэтому круг гельминтов, которые используют в баренцевоморских экосистемах птиц в качестве окончательных хозяев и которые заведомо не могут быть связаны с бургомистрами своими жизненными циклами, довольно ограничен. Кроме того, как уже упоминалось, распространение бургомистров в Баренцевоморском регионе приурочено в основном к арктическим районам. Обитание чаек в экстремальных условиях может приводить к снижению общей резистентности организма, что, в свою очередь, позволяет успешно развиваться в них многим гельминтам, обычно использующим в качестве окончательных хозяев других птиц. Находки таких паразитов, в частности, были описаны у бургомистров Шпицбергена [22].
Вместе с тем, значения количественных параметров инвазии (ЭИ и ИО) у большинства видов паразитов, найденных в бургомистрах, невелики. Такая особенность, видимо, объясняется двумя причинами. Во-первых, из-за неблагоприятных условий среды, а также снижения разнообразия потенциальных промежуточных хозяев циркуляция многих гельминтов (прежде всего трематод) в арктических биоценозах затруднена, и, соответственно, вероятность попадания в окончательного хозяина незначительна [38, 39]. Во-вторых, бургомистры активно используют те варианты кормовой стратегии, при которых шансы на заражение гельминтами минимальны – хищничество, сбор пищевых отходов и наземных кормов (ягод, семян растений, мелких грызунов) [1, 7, 11].
Проведение корректного сравнительного анализа зараженности бургомистров в западной и восточной частях моря, несмотря на ряд обнаруженных различий, довольно затруднительно. Многие гельминты, которые отсутствовали в одном районе, во втором отмечались в единичных случаях (трематоды Gymnophallus sp (somateriae?), Microphallus sp (pygmaeus?), Maritrema arenaria, представители р. Diplostomum; цестоды Diphyllobothrium ditremum, Microsomacanthus diorchis, Alcataenia larina, Aploparaksis brachiphallos; нематоды Streptocara crassicauda, Seuratia sp (shipleyi?), Capillaria sp). Такие отличия могут носить случайный характер. Кроме того, определенное значение для итоговых результатов мог иметь и тот факт, что в каждом районе было обследовано разное число птиц. Скорее всего, именно это обстоятельство было основной причиной отмеченных межрегиональных различий в инвазии бургомистров нематодами Anisakis sp (simplex?), Contracaecum osculatum и H. aduncum. И, наконец, пути циркуляции ряда паразитов в экосистемах Баренцева моря пока неизвестны (цестоды Arctotaenia tetrabothrioides, представители р. Wardium; нематоды S. stellaepolaris), а у некоторых (T. cylindraceus, T. morschtini) не установлен видовой состав вторых промежуточных хозяев, что также осложняет трактовку и интерпретацию имеющихся данных. Тем не менее, представляется возможным определить некоторые закономерности пространственного распределения гельминтов, завершающих свое развитие в баренцевоморских бургомистрах.
Обращает на себя внимание следующая характерная особенность – из повсеместно встречающихся паразитов для большинства вторыми промежуточными или паратеническими хозяевами служат рыбы (цестоды T. erostris, нематоды P. adunca, скребни C. strumosum) [9, 33, 41], или же их единственные промежуточные хозяева – ракообразные (цестоды Microsomacanthus microsoma, M. ductilus, Alcataenia dominicana, Anomotaenia micracantha micracantha; скребни Polymorphus phippsi) [23, 24, 29, 35, 42, 50]. Многие ракообразные и рыбы почти повсеместно распространены в Баренцевоморском регионе, и благодаря этому гельминты, использующие их в качестве промежуточных или паратенических хозяев, обнаруживаются у птиц в самых разных районах. Различия в значениях количественных параметров инвазии некоторыми из указанных видов паразитов (табл. 1) объясняются, скорее всего, разной степенью встречаемости и доступности таких кормовых объектов для птиц в том или ином участке ареала. Исключение составляют трематоды Gymnophallus deliciosus и цестоды Paricterotaenia porosa. У гимнофаллид роль первых промежуточных хозяев играют двустворчатые моллюски, вторых промежуточных – полихеты [44-46]. Однако при неблагоприятных условиях (холодное время года, отсутствие вторых промежуточных хозяев) инвазионные для окончательных хозяев метацеркарии трематод могут развиваться и в первых промежуточных хозяевах [44]. Такая вариабельность жизненного цикла, видимо, и обеспечивает гимнофаллидам возможность успешной циркуляции в различных районах. У P. porosa роль промежуточных хозяев играют личинки комаров [16, 28], которые могут быстро развиваться даже во временных пресных водоемах. При посещении пресноводных водоемов чайки могут заглатывать инвазированных личинками цестод промежуточных хозяев вместе с водой. Поэтому широкое распространение P. porosa в Баренцевоморском регионе также вполне объяснимо.
Заслуживает отдельного рассмотрения полное отсутствие у бургомистров на восточном участке моря трематод C. lingua, в то время, как в западном районе этими гельминтами было заражено свыше 40% обследованных птиц (табл. 1). В северо-восточной части Баренцева моря (прежде всего на побережьях Земли Франца-Иосифа и Северного острова Новой Земли) их циркуляция невозможна из-за отсутствия первых промежуточных хозяев – литоральных моллюсков р. Littorina. В юго-восточном секторе (прибрежье Южного острова Новой Земли, островов Колгуев и Вайгач, п-ова Канин) гастроподы L. saxatilis и L. obtusata встречаются, однако заражение личинками и партенитами C. lingua у них не отмечено, а основной первый промежуточный хозяин – L. littorea – в указанных районах не обитает [38]. Поэтому успешная реализация жизненного цикла C. lingua в этой части моря также неосуществима, хотя потенциальные вторые промежуточные хозяева трематод – рыбы, экологически связанные с зоной литорали – здесь достаточно многочисленны. Вообще, уменьшение встречаемости в литоральных моллюсках личинок трематод с треххозяинными жизненными циклами в направлении с запада на восток – особенность, характерная для побережий в южной части Баренцева моря [38]. Возможно, что именно с этим связано и отсутствие у бургомистров в восточной части водоема эхиностоматид Himasthla larina, у которых роль первых промежуточных хозяев играют те же гастроподы р. Littorina, а вторых промежуточных – мидии Mytilus edulis [10].
Необходимо отметить, что ни для одного из видов гельминтов, обнаруженных у бургомистров, этот вид чаек не был единственным окончательным хозяином – у каждого в качестве дефинитивного хозяина на Баренцевом море отмечен, как минимум, еще один вид птиц [21]. Наибольшее число общих видов в составе гельмитофауны было отмечено у бургомистров с морскими и серебристыми чайками, а также с моевками (табл. 2).
Таблица 2
Количество общих видов и значения коэффициента Серенсена для гельминтофаун бургомистров и других видов чаек Баренцева моря
|
Виды птиц |
Количество общих видов в составе гельминтофауны |
Значения коэффициента Серенсена (Ks) |
|
Бургомистр – морская чайка |
22 |
0.69 |
|
Бургомистр – серебристая чайка |
22 |
0.61 |
|
Бургомистр – моевка |
18 |
0.57 |
Кроме того, общие с бургомистрами виды гельминтов на Баренцевом море имеют обыкновенные гаги (8 видов), морские песочники и атлантические глупыши (по 5 видов); у полярных крачек, тонкоклювых и толстоклювых кайр, атлантических чистиков и гаг-гребенушек найдено по 1–2 вида паразитических червей, отмеченных и у бургомистров [21].
Сопоставление количества видов в гельминтофауне бургомистров (34) с общим числом паразитов, найденных к настоящему времени у всех птиц Баренцева моря в целом (94 вида) [21], на первый взгляд, должно поставить под сомнение корректность и эффективность использования этих чаек в качестве индикаторов паразитологической обстановки. Однако детальный анализ экологии и распространения гельминтов баренцевоморских птиц, не найденных у бургомистров, показал, что ситуация не так однозначна. Прежде всего, из числа этих паразитов 17 циркулируют в пресноводных биоценозах, и данные по зараженности птиц такими гельминтами для оценки паразитологического фона на Баренцевом море имеют лишь косвенное значение. Еще 16 не были определены с точностью до вида, поскольку были либо обнаружены в неполовозрелом состоянии, либо материал имел плохую сохранность после долгой предварительной заморозки. Поэтому вполне возможно, что зрелые и хорошо сохранившиеся экземпляры многих представителей этих таксонов в действительности обнаруживались у бургомистров. Из оставшихся 22 вида были зарегистрированы только на побережье Мурмана (причем находки 9 из них были единичными), где к настоящему времени обследовано очень небольшое число бургомистров [19]. Реализация жизненных циклов 4 видов происходит в морской пелагиали. На открытой акватории Баренцева моря на сегодняшний день изучена лишь гельминтофауна глупышей и моевок [18].
Следовательно, отсутствие находок у бургомистров многих гельминтов может быть связано не с тем, что паразиты и потенциальные окончательные хозяева пространственно и экологически разобщены, или же паразиты не могут нормально развиваться в неспецифичном виде птиц. Вполне вероятно, что ситуация объясняется недостаточным объемом проведенных исследований и отсутствием данных по некоторым районам. Восполнение этих пробелов позволит дать более объективную оценку возможностям использования бургомистра в качестве вида-индикатора “паразитологического фона” на Баренцевом море. С учетом имеющихся на настоящий момент данных, именно этот вид птиц представляется наиболее перспективным объектом для указанной цели. Для полноты и корректности информации по этому вопросу необходимо проведение дополнительных исследований гельминтофауны бургомистров на Мурманском побережье, открытой акватории и в Печорском море, а также уточнение путей циркуляции некоторых гельминтов в баренцевоморских экосистемах.
Заключение
Таким образом, для гельминтофауны бургомистров Баренцева моря характерно значительное видовое разнообразие, обусловленное широким распространением, высокой трофической пластичностью и, возможно, физиологическими особенностями птиц (пониженной резистентностью в связи с обитанием в неблагоприятных условиях внешней среды). Вместе с тем у большинства видов гельминтов отмечены невысокие значения количественных показателей инвазии. В западной части Баренцева моря фауна паразитических червей бургомистров разнообразнее, чем в восточной, ввиду более благоприятных условий для реализации жизненных циклов многих гельминтов. Проведенный анализ гельминтофауны бургомистров показал, что разрешающая способность использования этих птиц в качестве вида-индикатора паразитологической обстановки может быть достаточно высока.
Работа выполнена при финансовой поддержке РФФИ (грант № 15-04-03785).
Литература
1. Белопольский Л. О. Экология морских колониальных птиц Баренцева моря. – М.; Л.: Изд-во АН СССР, 1957. – 460 с.
2. Бондаренко С. К., Контримавичус В. Л. Основы цестодологии. Аплопараксиды диких и домашних птиц. – М.: Наука, 2006. – Т. 14. – 443 с.
3. Галактионов К. В., Марасаев С. Ф., Тимофеева С. В., Марасаева Е. Ф. Методы оценки паразитологической ситуации в прибрежье Баренцева моря. – Апатиты: Изд-во Кольского филиала АН СССР, 1988. – 48 с.
4. Галкин А. К., Галактионов К. В., Марасаев С. Ф., Прокофьев В. В. Цестоды рыбоядных птиц острова Харлов и Земли Франца-Иосифа // Паразитология. – 1994. – Т. 28, № 6. – С. 421–430.
5. Горбунов Г. П. Птичьи базары Новой Земли // Тр. Научно-исслед. Инст. по изуч. Севера. М.: Изд-во Научно-технического отдела ВСНХ, 1925. – Т. 26. – С. 1–48.
6. Горбунов Г. П. Птицы Земли Франца-Иосифа // Тр. Арктич. Инст. Л.: Гидрометеоиздат, 1932. – Т. 4. – 244 с.
7. Демме Н. П. Птичий базар на скале Рубини (остров Гукера, Земля Франца-Иосифа) // Тр. Арктич. Инст. Л.: Изд-во Главсевморпути, 1934. – Т. 11. – С. 55–86.
8. Животовский Л. А. Популяционная биометрия. – М.: Наука, 1991. – 271 с.
9. Зубченко А. В., Карасев А.Б. Паразитофауна рыб Баренцева моря. Морские рыбы // Ихтиофауна и условия ее существования в Баренцевом море. – Апатиты: Изд-во Кольского филиала АН СССР, 1986. – С. 151-160.
10. Ишкулов Д. Г., Куклин В. В. К фауне химастлин Восточного Мурмана // Паразитология. – 1998. – Т. 32, № 1. – С. 84–94.
11. Карпович В. Н., Коханов В. Д. Фауна птиц острова Вайгач и северо-востока Югорского полуострова // Тр. Кандалакш. гос. заповедника. – М.: Изд-во Лесная промышленность, 1967. – Вып. 5. – С. 268–335.
12. Коханов В. Д. Современные ареалы чаек на Белом море и Мурмане // Научные основы обследований колониальных гнездовий околоводных птиц. – М: Изд-во МОИП, 1981. – С. 63–64.
13. Коханов В. Д., Скокова Н. Н. Фауна птиц Айновых островов // Тр. Кандалакш. гос. заповедника. – М.: Изд-во Лесная промышленность, 1967. – Вып. 5. – С. 185–267.
14. Краснов Ю. В., Горяев Ю. И. Основные тенденции развития авифауны Кольского залива и факторы, ее определяющие // Птицы северных и южных морей России: фауна, экология. – Апатиты: Изд-во КНЦ РАН, 2013. – С. 38–64.
15. Краснов Ю. В., Матишов Г. Г., Галактионов К. В., Савинова Т. Н. Морские колониальные птицы Мурмана. – СПб.: Наука, 1995. – 224 с.
16. Краснощеков Г. П., Томиловская Н. С. Морфология и развитие цистицеркоидов Paricterotaenia porosa // Паразитология. – 1978. – Т. 12, № 2. – С. 108–116.
17. Куклин В. В. К гельминтофауне морских птиц губы Архангельской (Северный остров Новой Земли) // Паразитология. – 2001. – Т. 35, № 2. – С. 124–134.
18. Куклин В. В. Особенности гельминтофауны птиц открытой акватории Баренцева моря // Российский паразитологический журнал. – 2013. – № 3. – С. 16–21.
19. Куклин В. В. Особенности гельминтофауны морских птиц и реализации жизненных циклов паразитов в прибрежье Мурмана (Баренцево море) в зимний период // Доклады Академии Наук. – 2015. – Т. 461, № 5. – С. 612–615.
20. Куклин В. В., Куклина М. М. Гельминты птиц Баренцева моря: фауна, экология, влияние на хозяев. – Апатиты: Изд-во КНЦ РАН, 2005. – 290 с.
21. Куклин В. В., Куклина М. М. Гельминтофауна птиц Баренцева и Карского морей и взаимоотношения в системе гельминты – морские птицы // Птицы северных и южных морей России: фауна, экология. – Апатиты: Изд-во КНЦ РАН, 2013. – С. 159–177.
22. Куклин В. В., Галактионов К. В., Галкин А. К., Марасаев С. Ф. Сравнительный анализ гельминтофауны моевок Rissa tridactyla (Linnaeus, 1758) и бургомистров Larus hyperboreus (Gunnerus, 1767) из различных районов Баренцева моря // Паразитология. – 2005. – Т. 39, №. 6. – С. 544–558.
23. Кулачкова В. Г., Битюкова С. В. Литоральные гаммарусы как источник заражения гельминтами рыб и птиц Белого моря // Вопросы паразитологии водных беспозвоночных. – Вильнюс: Изд-во Минтис, 1980. – С. 57–59.
24. Марасаева Е. Ф. Экологический анализ паразитофауны бокоплава Gammarus oceanicus на литорали Восточного Мурмана // Морфология и экология паразитов морских животных. – Апатиты: Изд-во КНЦ АН СССР, 1990. – С. 76–88.
25. Марков Г. С. Паразитические черви птиц губы Безымянной (Новая Земля) // Доклады АН СССР. – 1941. – Т. 30, № 6. – С. 573–576.
26. Песенко Ю. А. Принципы и методы количественного анализа в фаунистических исследованиях. – М.: Наука, 1982. – 287 с.
27. Рубенчик Л. И. Микроорганизмы – биологические индикаторы. – Киев: Наукова думка, 1972. – 163 с.
28. Томиловская Н. С. Личинки цестод дилепидид птиц Чаунской низменности // Паразитические организмы Северо-Востока Азии. – Владивосток: Дальневост. изд-во, 1975. – С. 224–232.
29. Успенская А. В. Паразитофауна бентических ракообразных Баренцева моря. – Л.: Изд-во АН СССР, 1963. – 128 с.
30. Юдин К. А., Фирсова Л. В. Серебристая чайка // Птицы СССР. Чайковые. – М.: Наука, 1988 а. – С. 126–146.
31. Юдин К. А., Фирсова Л. В. Бургомистр // Птицы СССР. Чайковые. – М.: Наука, 1988 б. С. – 165–174.
32. Юдин К. А., Фирсова Л. В. Морская чайка // Птицы СССР. Чайковые. – М.: Наука, 1988 в. – С. 174–182.
33. Anderson R. C., Wong P. L. The transmission and development of Paracuaria adunca (Creplin, 1846) (Nematoda: Acuarioidea) of gulls (Laridae) // Can. J. Zool. – 1982. – Vol. 60. – P. 3092–3104.
34. Bost C. A., Le Maho Y. Seabirds as bio-indicators of changing marine ecosystems: new perspectives // Acta Oecologia. – 1993. – Vol. 14 (3). – P. 463–470.
35. Burt M. D. B., Jarecka L. Studies on the life cycle of Hymenolepis ductilis Linton, 1927, and on the ultrastructure of its cystycercoid tegument // Acta parasit. Pol. – 1984. – Vol. 29. – P. 35–42.
36. Conti M. E., Cecchetti G. Biological monitoring: lichenes as bioindicators of air pollution assessment – a review // Environmental pollution. – 2001. – № 114. – P. 471–492.
37. Duffey E., Sergeant D. E. Field notes on the Bear Island // Ibis. – 1950. – Vol. 92. – P. 554–563.
38. Galaktionov K. V. Life cycles and distribution of seabird helminths in arctic and sub-arctic regions // Bulletin of Scandin. Soc. Parasitol. – 1996. – Vol. 6. (2). – Р. 31–49.
39. Galaktionov К. V., Bustnes J. O. Distribution patterns of marine bird digenean larvae in periwinkles along the southern Barents Sea coast // Diseases of Aquatic Organisms. – 1999. – Vol. 37. – P. 221–230.
40. Gefen E., Stone L., Rosenfeld M., von Westernhagen H. Biological indicators in marine and coastal waters: a statistical modeling analysis of the MARS campaign // Helgoland Marine Research. – 2003. – № 57. – P. 272–284.
41. Hoberg E. P. Recognition of larvae of the Tetrabothriidae (Eucestoda): implications for the origin of tapeworms in marine homeothermes // Can. J. Zool. – 1987. – Vol. 65. – P. 997–1000.
42. Jarecka L., Bance G. N., Burt M. D. B. On the life cycle of Anomotaenia micracantha dominicana (Railliet et Henry, 1912) with ultrastructural evidence supporting the definition cercoscolex for dilipidid larvae (Cestoda, Dilepililae) // Acta parasitol. Pol. – 1984. – Vol. 29. – P. 27–34.
43. Kristoffersen R. Occurrence of the digenean Cryptocotyle lingua in farmed Arctic charr Salvelinus alpinus and periwinkles Littorina littorea sampled close to charr farms in northern Norway // Diseases of Aquatic Animals. – 1991. – Vol. 12. – P. 59–65.
44. Lauckner G. Zur Trematodenfauna der Herzmuscheln Cardium edule und Cardium lamarcki // Helgoland Wiss. Meeresuntersuch. – 1971. – Bd. 22, Hf. 1. – Р. 377–400.
45. Loos-Frank B. Zur Kenntnis der gymnophalliden Trematoden des Nordseeraumes I. Die Alternativ-Zyklen von Gymnophallus choledochus Odhner, 1900 // Zeitschr. Parasitenk. – 1969 a. – Bd. 32. – P. 135–156.
46. Loos-Frank B. Der bemerkenswerte Lebenszyklus des marinen Vogeltrematoden Gymnophallus choledochus // Journ. Ornitol. – 1969 b. – Bd. 110, Hf. 4. – P. 471–474.
47. Løvenskiold H. L. Avifauna Svalbardensis with a discussion on the geographical distribution of the birds in Spitsbergen and adjacent island. – Oslo: Norsk Polarinstitute skrift, 1964. – 460 p.
48. Sagerup K., Henriksen E. O., Skorping A., Skaare J. U., Gabrielsen G. W. Intensity of parasitic nematodes increases with organochlorine levels in the Glaucous Gull // Journ. Appl. Ecol. – 2000. – Vol. 37. – P. 532–539.
49. Sindermann C. J. Effects of parasites on fish population: Practical consideration // Intern. Journ. for Parasitology. – 1987. Vol. 17 (2). – P. 371–382.
50. Shimazu T. Some cestodes and acanthocephalan larvae from euphasiid crustaceans collected in northern North Pacific Ocean // Bull. Jap. Soc. Scien. Fish. – 1975. – Vol. 41. – P. 813–821.
© 2017 The Authors. Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin. This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI)http://elibrary.ru/projects/citation/cit_index.asp) and the Agreement of 12.06.2014 (CABI.org / Human Sciences section: http://www.cabi.org/Uploads/CABI/publishing/fulltext-products/cabi-fulltext-material-from-journals-b...