Скачать в PDF формате презентацию
English Version
К ВОПРОСУ О МЕХАНИЗМАХ ГЕНЕТИЧЕСКОЙ И ИНДУЦИРОВАННОЙ УСТОЙЧИВОСТИ ТОМАТОВ К ГАЛЛОВОЙ НЕМАТОДЕ MELOIDOGYNE INCOGNITA (KOFOID & WHITE, 1919) CHITWOOD, 1949
Лаврова В.В.*, Удалова Ж.В.**,***, Матвеева Л.М.*,
Зиновьева С.В.**, Калинкина Д.С.*
* ФГБНУ Институт биологии Карельского научного центра РАН, Петрозаводск
** ФГБНУ Центр паразитологии ИПЭЭ РАН, Москва
*** ФГБНУ «Всероссийский НИИ фундаментальной и прикладной паразитологии животных и растений им. К.И.Скрябина»
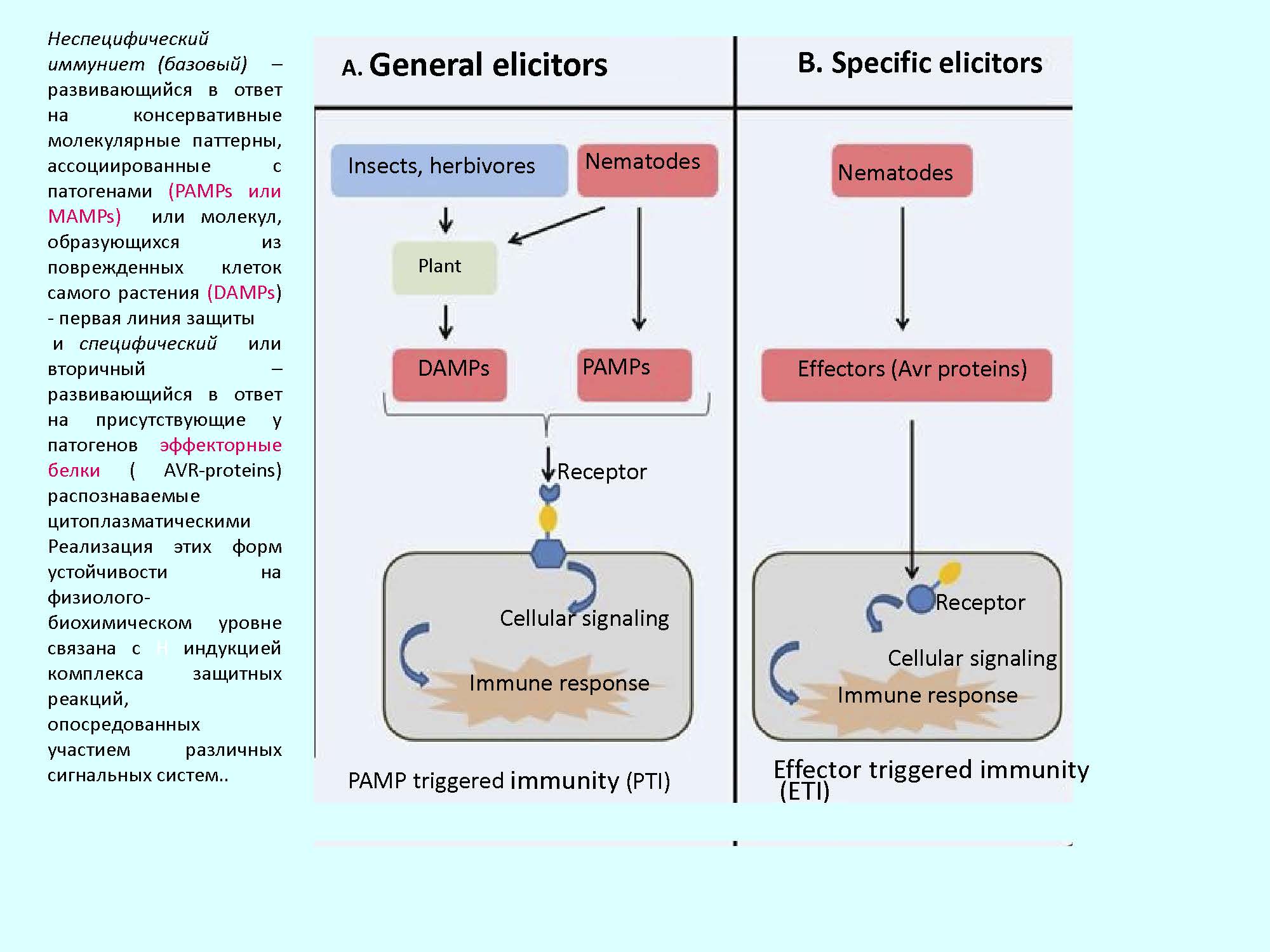
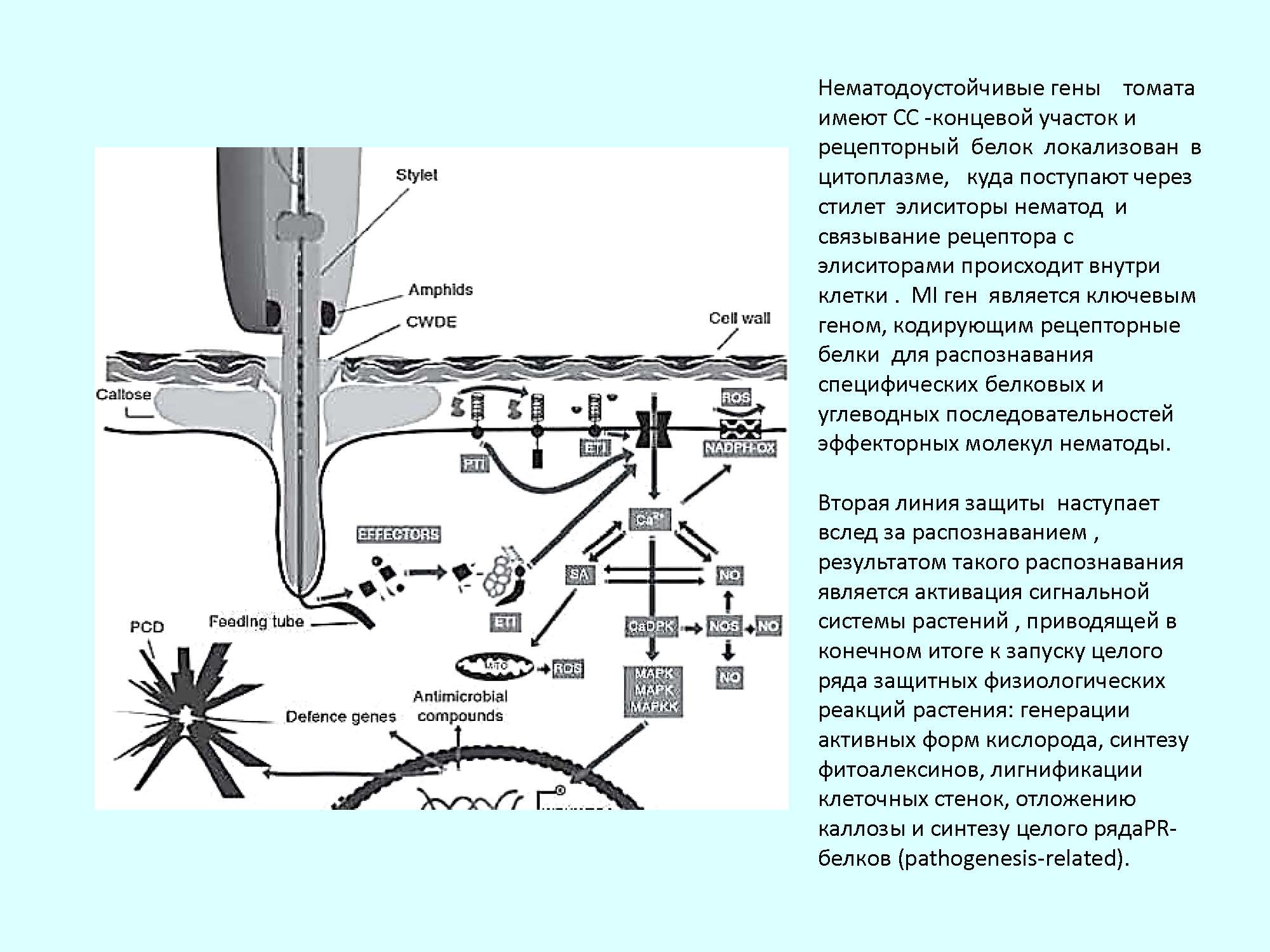
Введение. Характер взаимоотношений фитопаразитических нематод с растением-хозяином во многом определяется способностью растительного организма быстро и специфично модулировать свой транскриптом, т.е. изменять экспрессию генов, связанных с развитием защитных реакций в ответ на заражение. Иммунный ответ растения на контакт с нематодой начинается с реакции «узнавания» паразита. Основная роль в этом процессе отводится генам устойчивости – R генам (от англ. resistance), кодирующим рецепторные белки, распознающие эффекторы, секретируемые личинками нематод на этапе их внедрения в корни. Это обеспечивает межклеточное узнавание партнеров и индукцию адекватной системы защиты, что наблюдается у растений, обладающих генетической устойчивостью, быстро реагирующих на нематодную инвазию [1]. У восприимчивых растений R гены либо отсутствуют, либо находятся в неактивном состоянии, и при внедрении нематоды защитные реакции хозяина не включаются или запускаются слишком поздно.
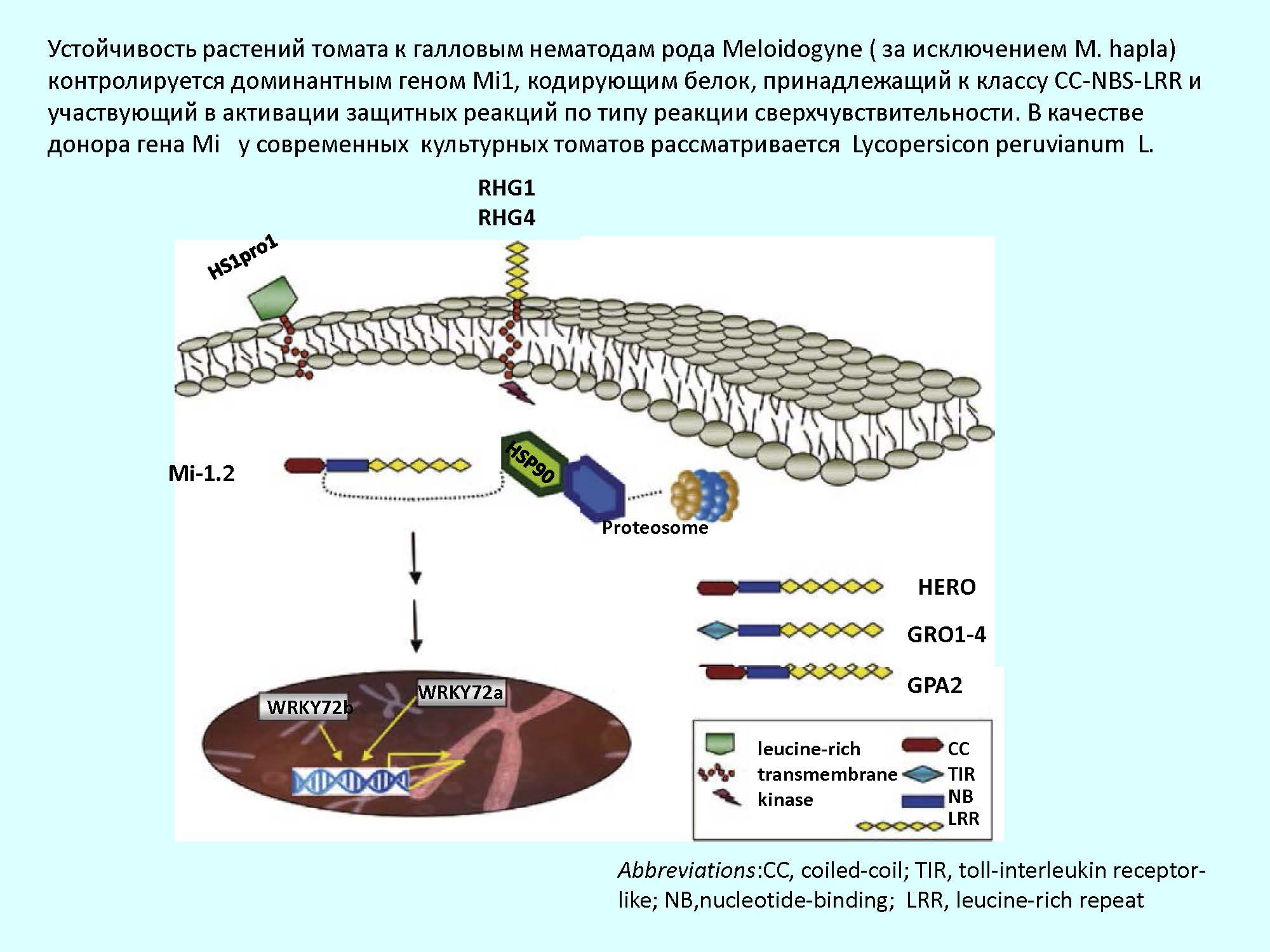
Устойчивость растений томата к галловым нематодам рода Meloidogyne (M. arenaria, M. incognita, M. javanica), за исключением M. hapla [2] контролируется доминантным геном Mi1, кодирующим белок, принадлежащий к классу СС-NBS-LRR и участвующим в активации защитных реакций по типу реакции сверхчувствительности [3].
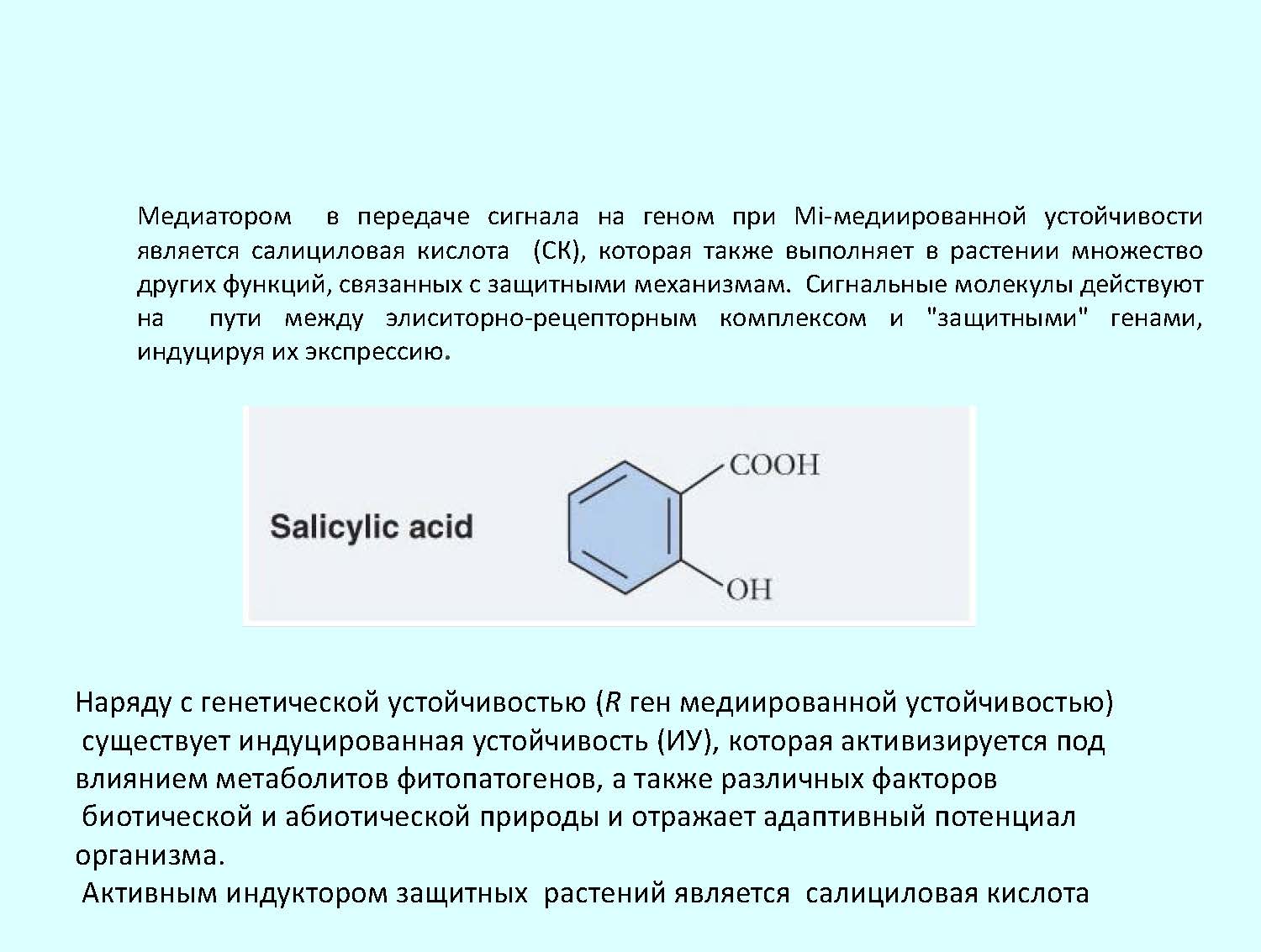
Наряду с генетической устойчивостью (R ген медиированной устойчивостью) существует индуцированная устойчивость (ИУ), которая активируется под влиянием метаболитов фитопатогенов, а также различных факторов биотической и абиотической природы и отражает адаптивный потенциал организма. Активным индуктором защитных реакций является салициловая кислота (СК), которая является медиатором в передаче сигнала на ген при Mi-медиированной устойчивости, а также выполняет в растении множество других функций, связанных с защитными механизмам [4].
Материал и методы. Исследование проводили на растениях томата, различающихся по устойчивости к галловой нематоде Meloidogyne incognita (Kofoid & White, 1919) Chitwood, 1949 – устойчивом гибриде F1 Шагане и восприимчивом гибриде F1 Гамаюн.
Семена томатов перед посадкой выдерживали 2 часа в воде (контроль) или СК в концентрации 7х10-8 М в качестве индуктора устойчивости – (опыт). Через 3 нед. после прорастания часть растений заражали нематодой (3000 личинок на растение) и все растения опрыскивались контроль водой и опыт - СК.
Наличие гена устойчивости (Mi1.2) в генотипе томатов анализировали методом аллель-специфической ПЦР. Транскрипционную активность R гена оценивали методом ПЦР в режиме реального времени. В качестве флуорофора для детекции продуктов использовали интеркалирующий краситель SYBR Green. В качестве референсного гена использован актин. Праймеры для проведения ПЦР конструировались c использованием программы Primer3 (http://primer3plus.com) на основе нуклеотидных последовательностей генов, представленных в базе данных NCBI (номер доступа в базе для гена Mi1.2 – AF039682.1; гена Actin (томат) – FJ532351.1). Праймеры синтезировались в фирме Евроген, Россия.
Содержание СК в корнях и листьях опытных и контрольных томатов определяли с помощью ВЭЖХ в соответствии с методом Pocher et al. (1983) [5]. Количество образовавшегося фитоалексина ришитина, активность фенилаланинаммиак-лиазы (ФААЛ) и ингибиторов протеиназ (ИП) определяли по ранее описанным методикам [6].
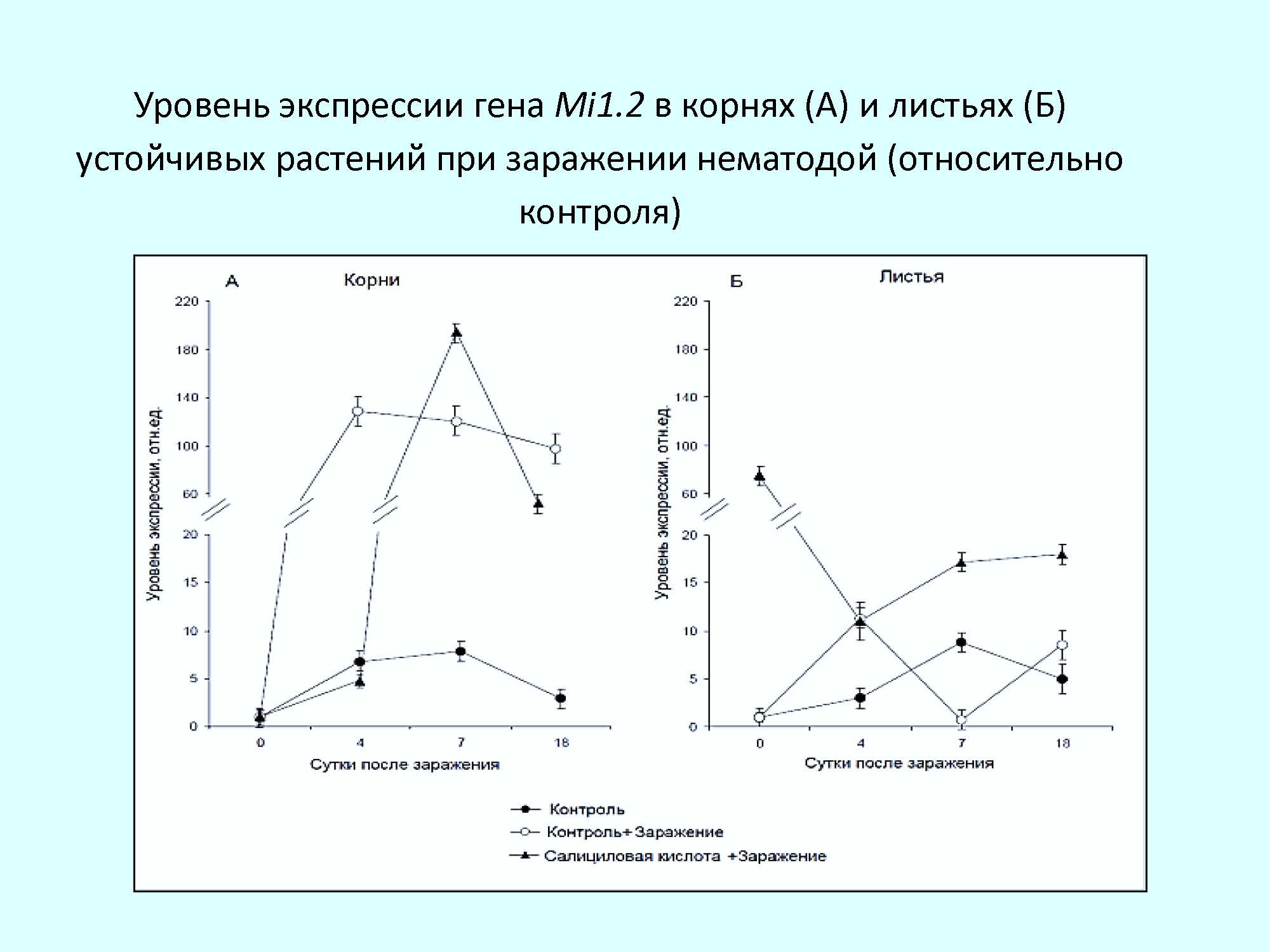
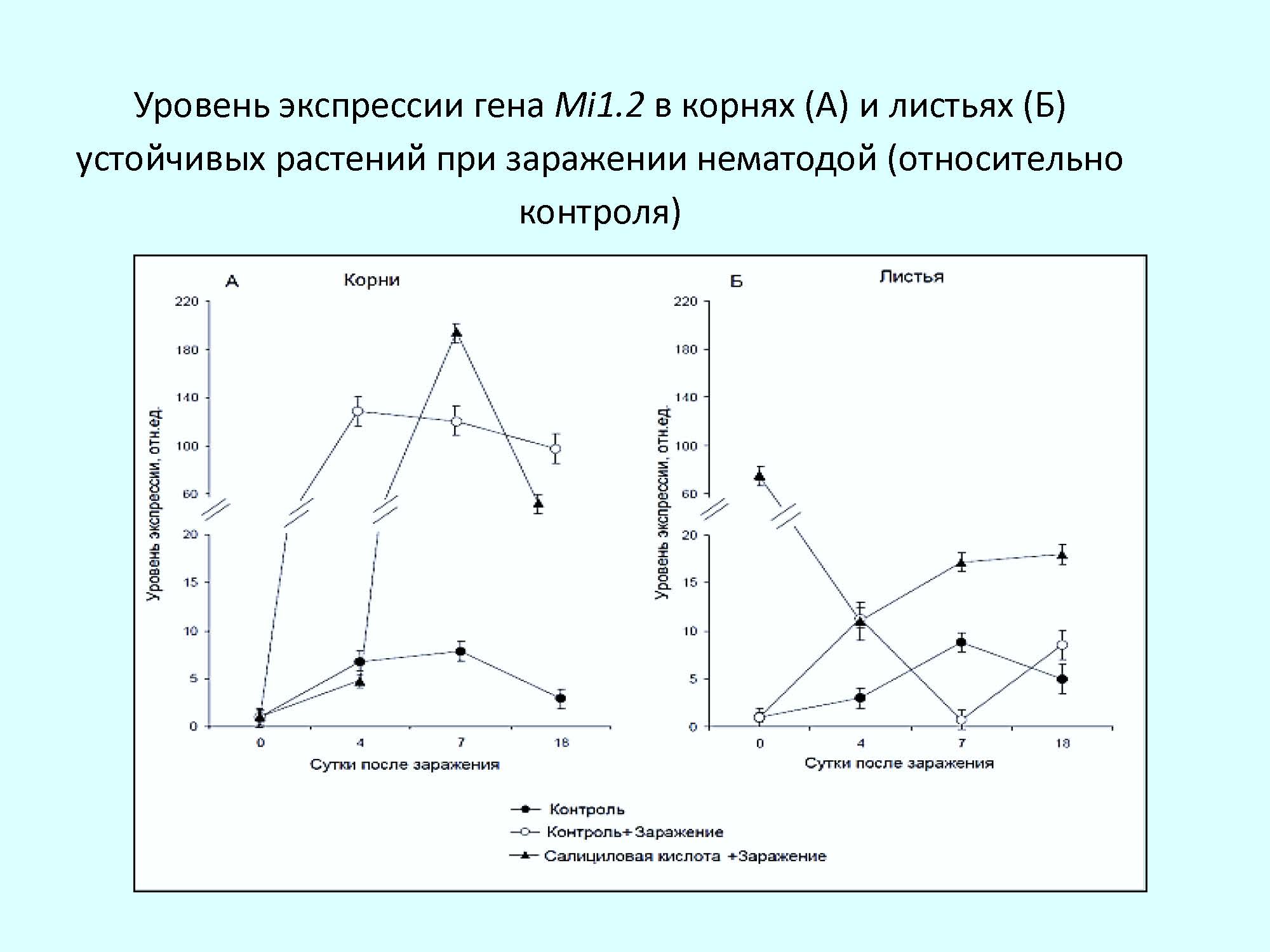
Результаты и обсуждение. Исследования показали, что у устойчивых и восприимчивых растений томата динамика экспрессии данного гена при заражении M. incognitа была различной. В период проникновения личинок нематоды в корни устойчивого растения и по мере их питания и развития наблюдается повышение активности гена Mi1.2, при этом максимум экспрессии достигается на 4-е сутки, после чего уровень транскриптов остается на высоком уровне на протяжении всего начального периода заражения. Полученные данные выявили также наличие транскрипционной активности R гена не только в корнях – местах внедрения нематод, но и в листьях – ткани, удаленной от места непосредственного поражения, как при генетической, так и индуцированной устойчивости. Это свидетельствует о развитии системного защитного ответа растений в ответ на заражение.
Анализ содержания мРНК гена Mi1.2 в корнях и листьях восприимчивых растений при заражении показал отсутствие накопления транскриптов, что свидетельствует о низкой активности гена на этапе становления паразито-хозяинных отношений (при проникновении личинок и начальных этапах развития нематоды).
Ранее нами было показано, что одной из ключевых молекул сигнального пути формирования устойчивости при инвазии томатов галловой нематодой является СК [4]. Сигнальные молекулы действуют на пути между элиситорно-рецепторным комплексом и "защитными" генами, индуцируя их экспрессию.
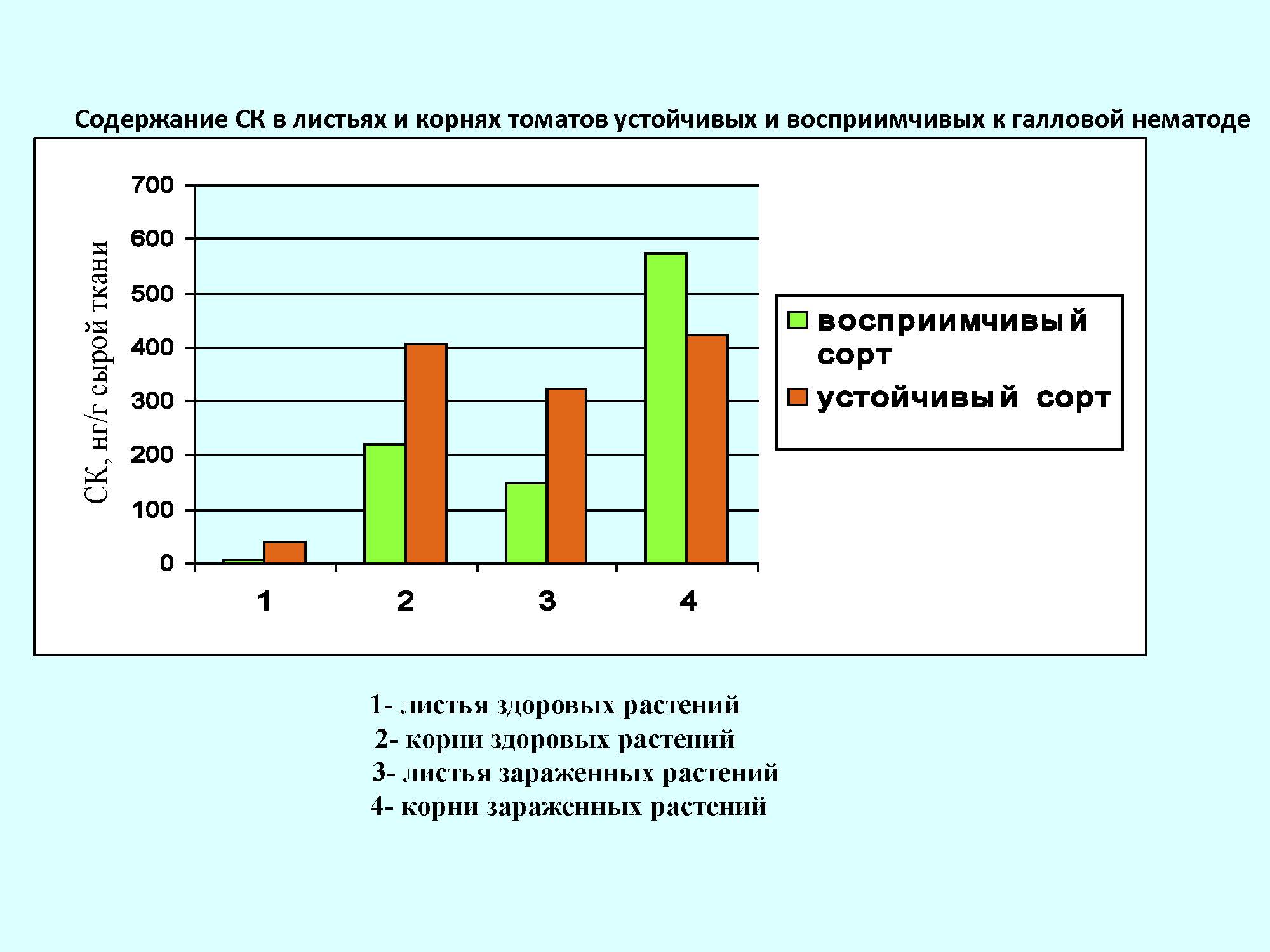
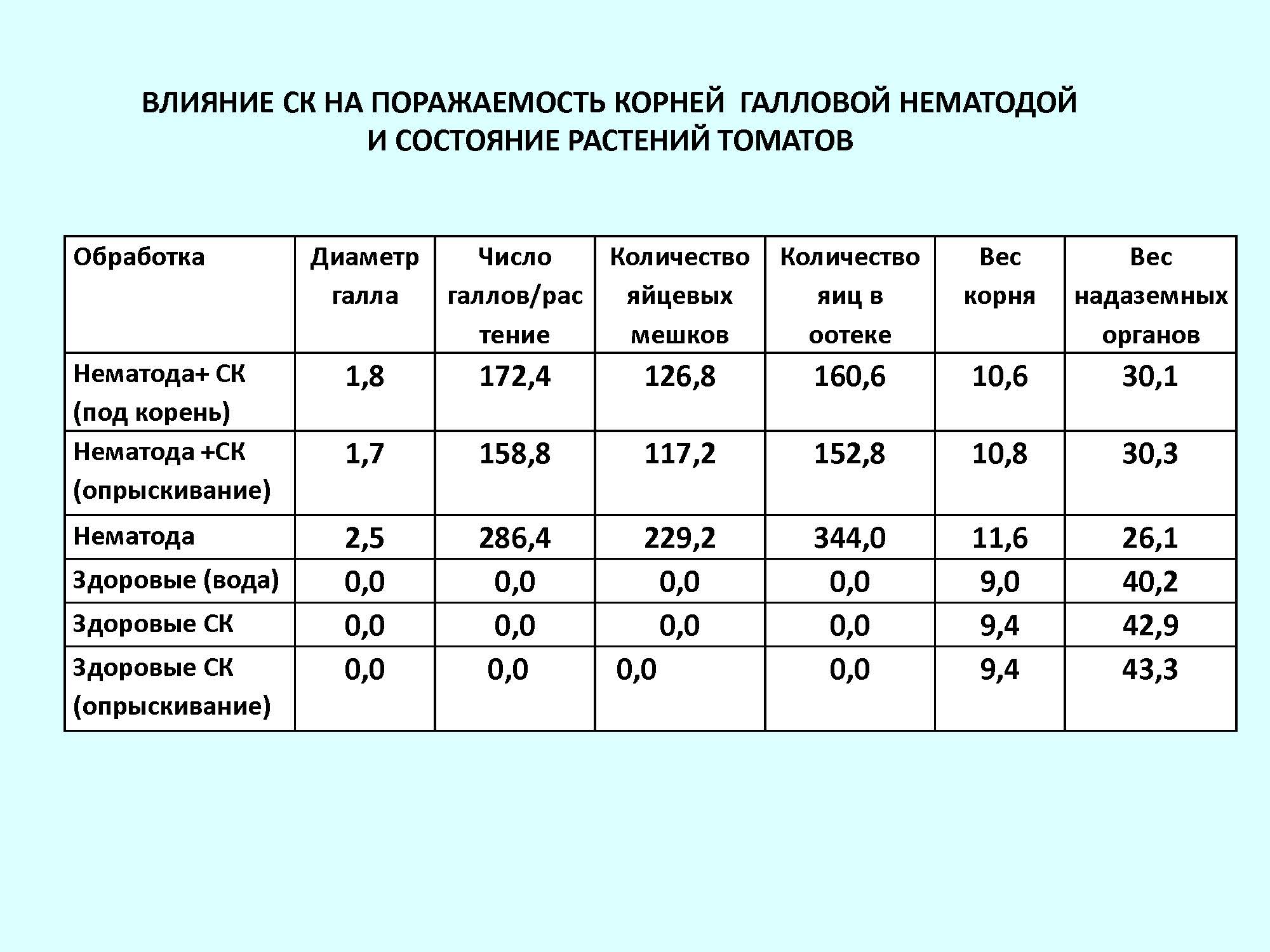
Определение содержания СК в томатах с разным уровнем устойчивости к галловой нематоде показало, что устойчивые растения обладали более высоким содержанием СК как в корнях, так и в листьях растений по сравнению с восприимчивыми. Заражение растений галловой нематодой повышало уровень СК в тканях растений: большее количество СК у устойчивого гибрида было обнаружено в листьях, тогда как у восприимчивых растений вызывало наибольшее увеличение СК в корнях – локализация нематод.
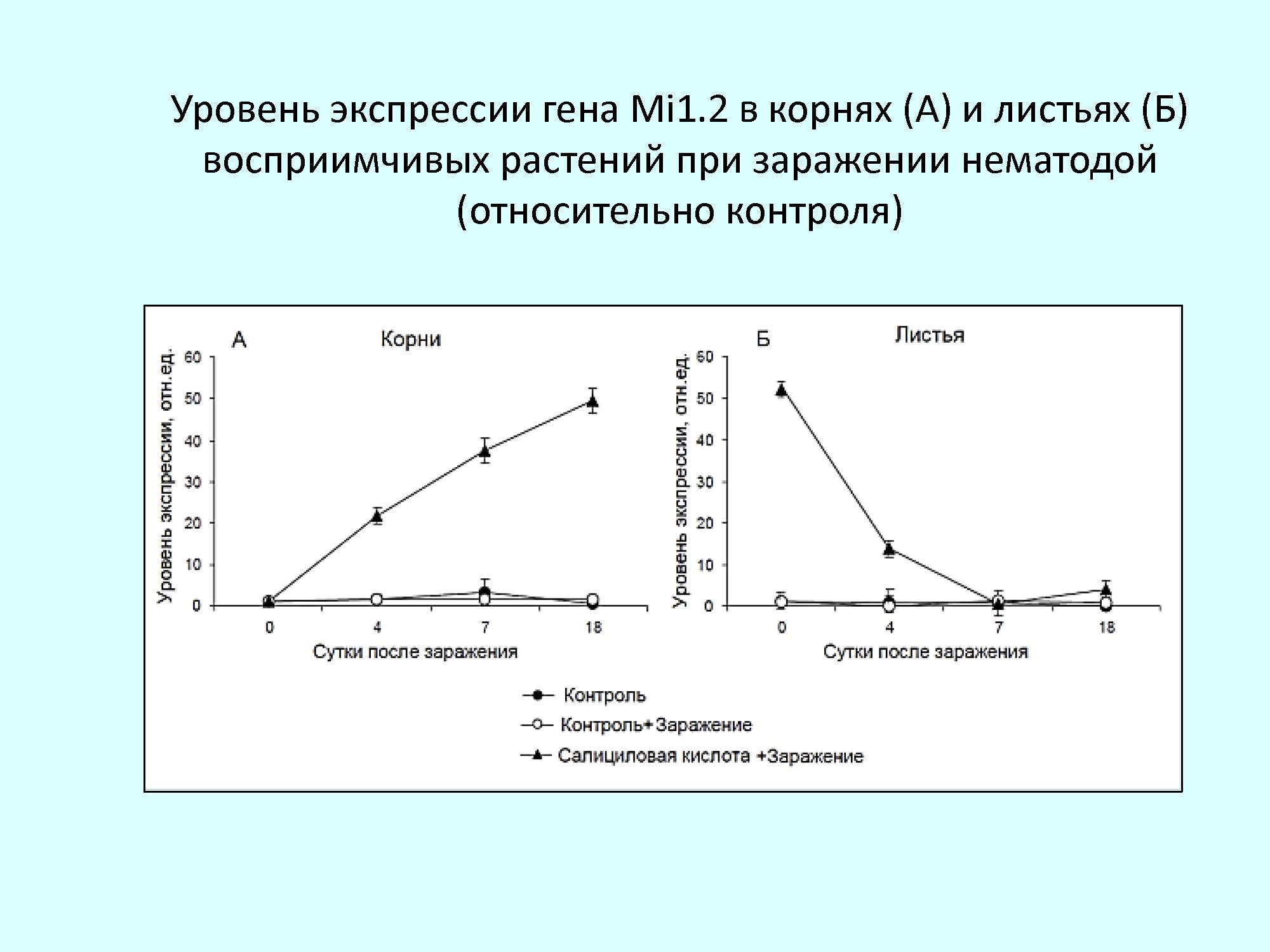
При экзогенной обработке надземных органов томата СК в листьях устойчивых и восприимчивых растений отмечено значительное повышение экспрессии гена Mi1.2, в то время как в корнях отсутствовали какие-либо изменения в его активности.
Анализ уровня накопления транскриптов гена Mi1.2 при заражении нематодой показал, что в корнях салицил-обработанных устойчивых растений сохраняется тенденция к повышению экспрессии гена со смещением максимального уровня к 7-м суткам. Для салицил-обработанных восприимчивых растений при заражении отмечена иная динамика экспрессии гена Mi1.2. В корнях, где на ранних этапах онтогенеза не было отмечено изменений активности этого гена, после заражения нематодой наблюдалось значительное повышение содержания транскриптов в период проникновения и питания личинок нематоды.
Передача сигнала в геном сопровождается изменением транскрипционной активности в тканях растений патогениндуцируемых генов (PR гены, от англ. pathogenesis-related genes), из которых наиболее исследованными являются белки 1, 2 и 3 групп (PR1, PR2, PR3), и ряд других биохимических факторов устойчивости (прежде всего фитоалексины (ФА), ингибиторы протеиназ (ИП) и фермент фенилаланинаммиак-лиаза (ФАЛ), участвующий в синтезе защитных соединений). В совокупности изменение активности перечисленных генов ведет к ограничению питания паразита и нарушению его развития.
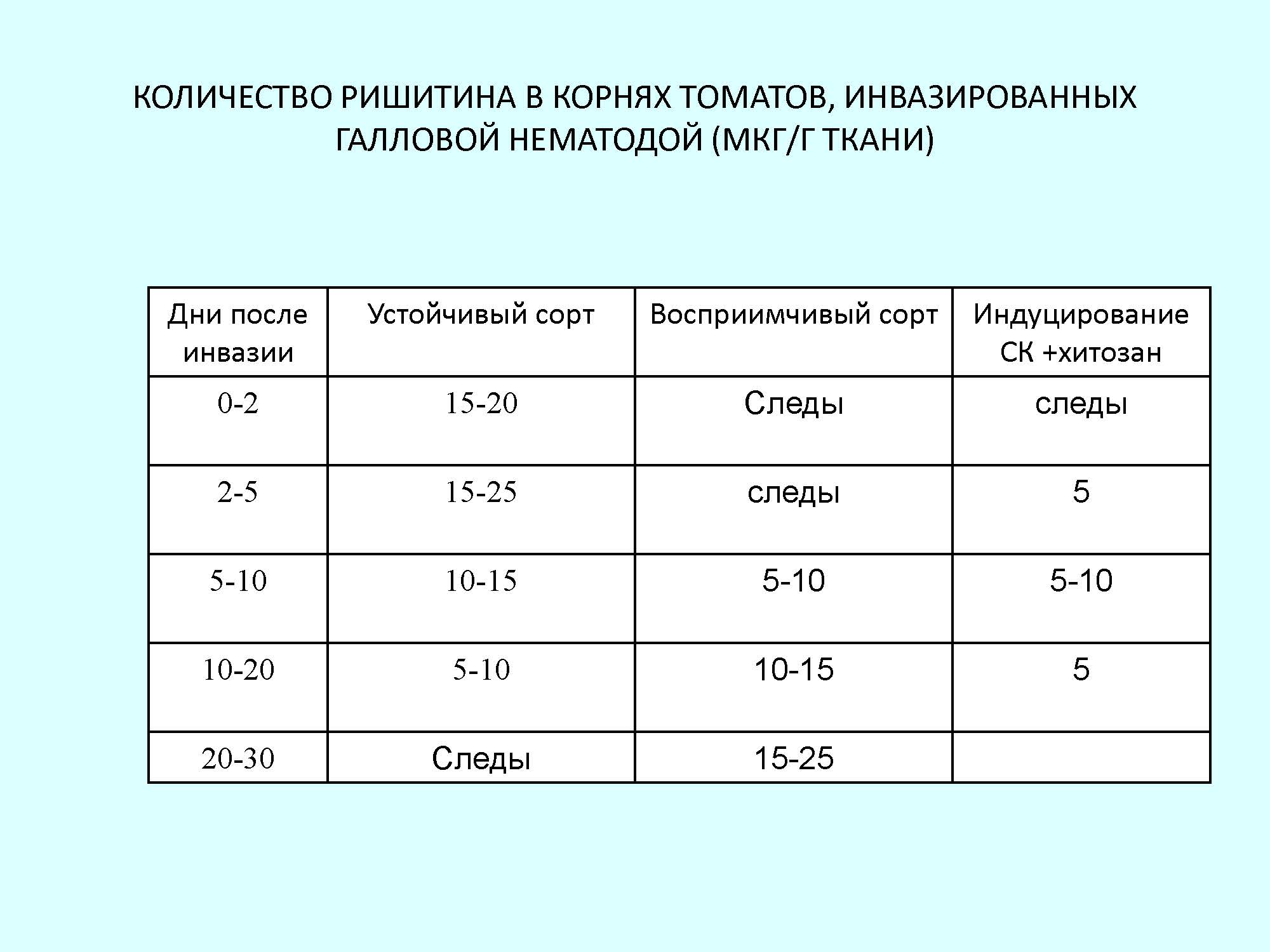
Проведённые исследования показали, что в корнях устойчивых томатов при инвазии в местах проникновения нематод уже на пятые сутки образуется ФА - ришитин, в то время как в корнях восприимчивых растений ФА появлялись лишь на 20-й день после инвазии и в количестве гораздо меньшем, чем в тканях устойчивых томатов.
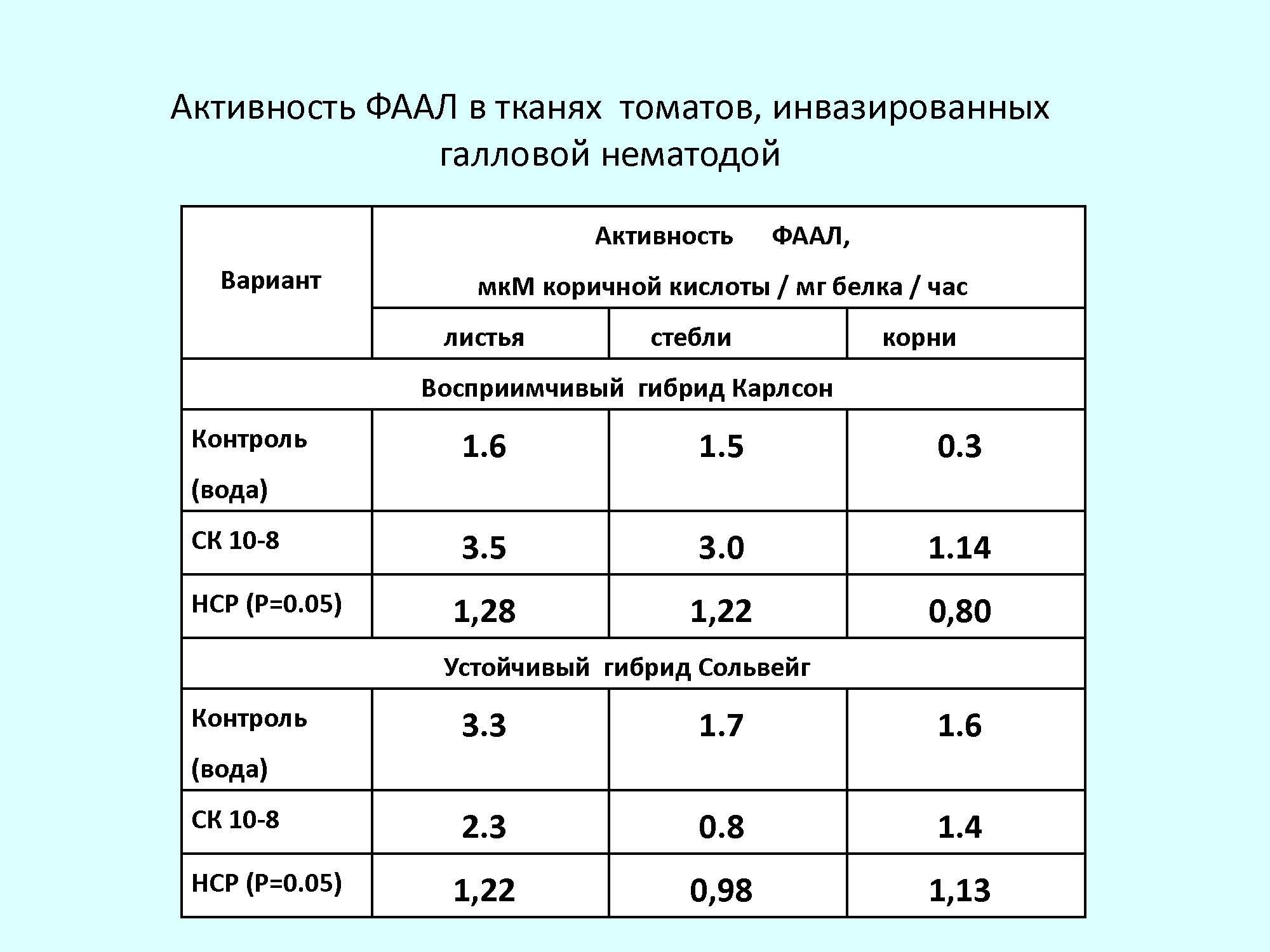
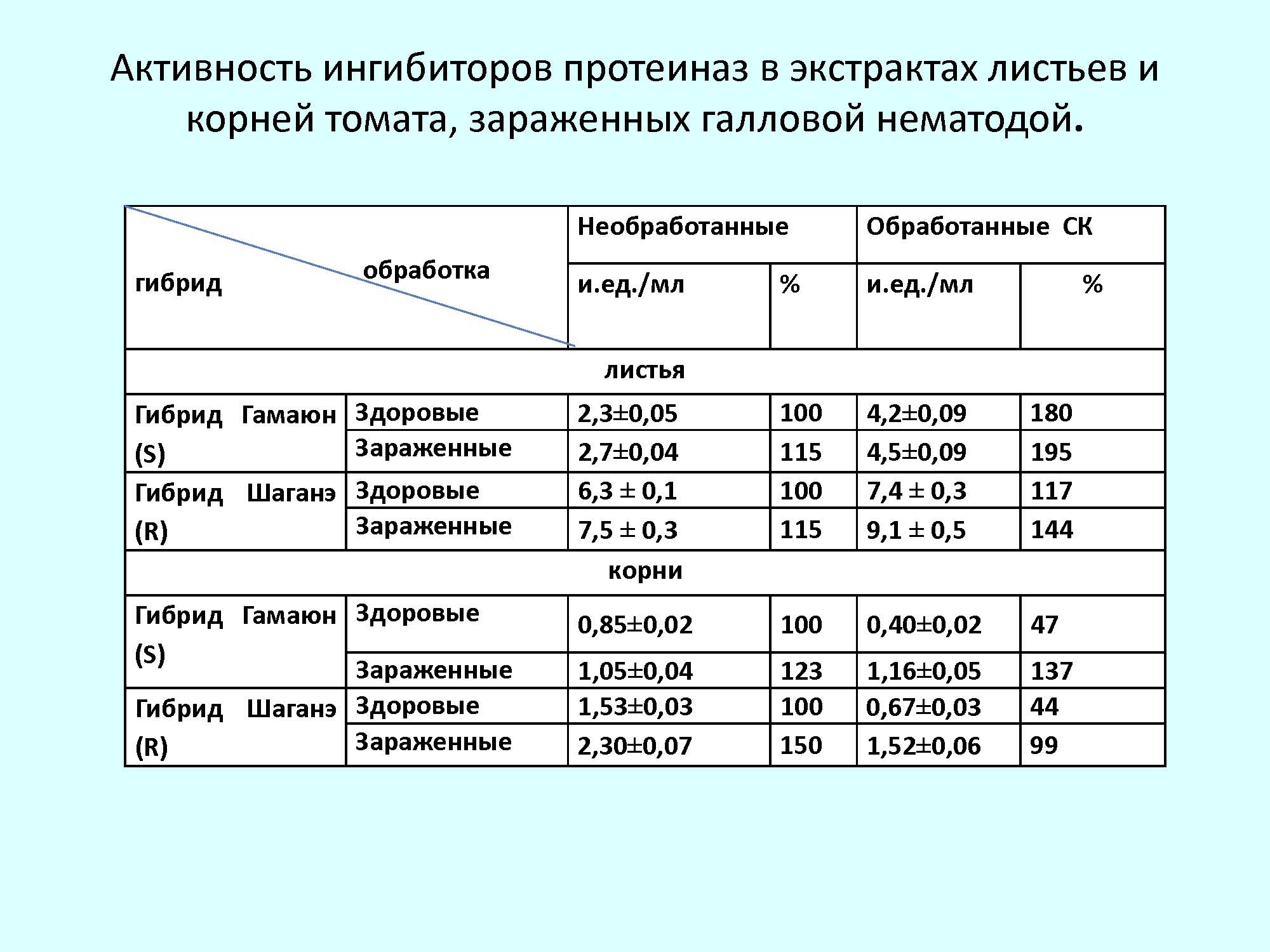
Анализ активности ИП в листьях растений томата, показал, что в восприимчивом к галловой нематоде гибриде Гамаюн активность была в 2,7 раза ниже по сравнению с устойчивым к данному паразиту гибридом. Заражение приводило к некоторому увеличению активности ИП (на 17% в восприимчивом гибриде и на 19% в устойчивом). В корнях томатов в активности ИП наблюдалась такая же тенденция, как и в листьях. В устойчивых к нематоде растениях активность была выше, чем в восприимчивых. Заражение приводило к усилению активности ИП.
Обработка растений СК увеличивала активность ИП в листьях и в здоровых и зараженных растениях. В корнях здоровых растений активность ИП при обработке увеличилась в 2 раза по сравнению с контролем, однако при заражении активность существенно снизилась.
Полученные данные показали, в листьях восприимчивых и устойчивых к нематоде здоровых растениях, активность ФАЛ достоверно не различается. Обработка растений СК приводила к повышению активности ФАЛ в восприимчивых растениях более чем в 2 раза (1.6 и 3.3), тогда как в устойчивом гибриде она несколько подавлялась (3.3 и 2.3). Обработка СК восприимчивых растений при инвазии активировала активность ФАЛ - в растениях наблюдалось увеличение активности на 20% по сравнению с необработанными. Можно предположить, что повышение активности ФАЛ связано, в основном, с индукцией системной устойчивости растений.
Заключение. Результаты исследований показали, что как восприимчивый, так и устойчивый гибриды томатов обладают активным геном устойчивости Mi1.2. Однако при заражении в тканях устойчивых растений экспрессия гена повышается, тогда, как у восприимчивых остается неизменной, что может быть одной из причин их восприимчивости к нематоде. Использование экзогенной обработки СК восприимчивых растений позволяет модулировать уровень накопления транскриптов генов устойчивости, тем самым смещать паразито-хозяинные отношения от восприимчивости хозяина к его устойчивости. Показано, что повышение экспрессии гена устойчивости Mi1.2 восприимчивых растений томата после обработки СК может быть достаточным для запуска защитных реакций (ФА, ИП, ФАЛ) при контакте с метаболитами паразита, а, соответственно, и повышения устойчивости к заражению M. incognita.
Работа выполнена при финансовой поддержке РФФИ (№ 15-04-04625_а).
Литература: 1. Gururani M.A., Venkatesh J., Upadhyaya C.P., Nookaraju A., Pandey S. K., Park S. W. // Physiological and Molecular Plant Pathology. – 2012. – V. 78. – P. 51–65. 2. Roberts P.A., May D., Matthew W.C. // California agriculture. – 1986. – P. 24 – 26. 3. Williamson V.M., Hwang C.F., Truesdell G., Bhakta A.V., Fort K.P. The nematode resistance gene, Mi. In: Biology of Plant Microbe Interactions. – 2000. vol 2. – P. 88–92. 4.Зиновьева С.В., Васюкова Н.И., Удалова Ж. В., Герасимова Н.Г., Озерецковская О.Л.// Известия РАН, Сер. биол. – 2011. – №5. – С.532-538. 5. Poncher M., Duprez V., Ricci P. // Act nort. – 1983. – V.141. – №2. – P. 61-55. 6. Udalova Zh. V., Zinoviev S.V. //Eological Engineering and Environment Protection. – 2015. – № 2. – P. 59-66.




© 2016 The Author(s). Published by All-Russian Scientific Research Institute of Fundamental and Applied Parasitology of Animals and Plants named after K.I. Skryabin.
This is an open access article under the Agreement of 02.07.2014 (Russian Science Citation Index (RSCI) and the Agreement of 12.06.2014 (CABI.org / Human Sciences section).